Phản ứng N2 + H2 → NH3
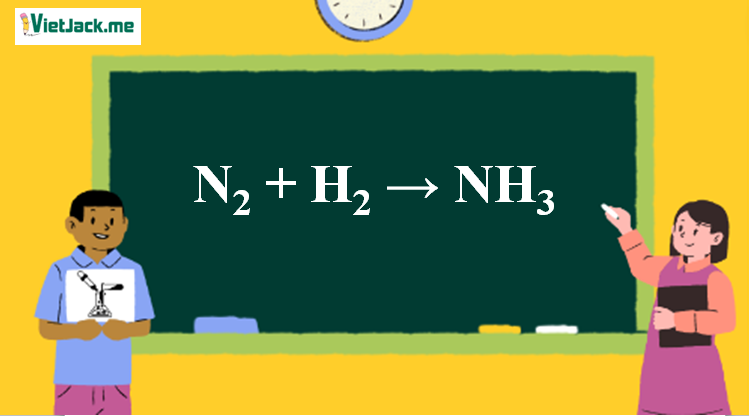
1. Phương trình phản ứng N2 ra NH3
N2 + 3H2 2NH3
2. Điều kiện phản ứng N2 tác dụng H2
Ở nhiệt độ cao, áp suất cao và có mặt chất xúc tác.
3. Tính chất của Nito
3.1. Tính chất vật lý
– Là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí (d = 28/29), hóa lỏng ở -196 ºC.
– Nitơ ít tan trong nước, hoá lỏng và hoá rắn ở nhiệt độ rất thấp. Không duy trì sự cháy và sự hô hấp (không độc).
3.2. Tính chất hóa học của Nito
Trong các hợp chất nitơ có các số oxi hóa: -3 ; +1 ; +2 ; +3 ; +4 ; +5. Các mức số oxi hóa tùy thuộc vào các nguyên tố khác trong hợp chất.
Do vậy Nitơ có tính oxi hóa và tính khử.
Tính oxi hóa vẫn là tính chất chủ yếu của nitơ
– Tính oxi hóa ( No + 3e → N-3)
a. Tác dụng với kim loại (Ca, Mg, Al,…) tạo thành nitrua kim loại.
Thí dụ:
Ca + N20 Ca3N2-3
b. Tác dụng với hiđro tạo ra khí amoniac
Điều kiện: Nhiệt độ cao, áp suất cao và có mặt chất xúc tác
N20 + 3H2 2N-3H3
Nhận xét: Trong những phản ứng thí dụ trên số oxi hóa của nguyên tố nit ơ giảm từ 0 đến – 3 => Nitơ thể hiện tính oxi hóa
– Tính khử
Nitơ tác dụng với oxi trong từng điều kiện khác nhau thì nguyên tử nitơ có số oxi hóa khác nhau.
Khoảng 3000oC ( hoặc nhiệt độ lò hồ quang điện), nitơ phản ứng trực tiếp với oxi tạo ra nitơ monooxit NO
N20 + O2 2N+2O
Nhận xét: Ở thí dụ trên số oxi hóa oxi tăng từ 0 lên + 2 => Nitơ thể hiện tính khử
Điều kiện thường, khí NO không màu tác dụng ngay với oxi trong không khí tạo ra nitơ đioxit NO2 có màu nâu đỏ:
2N+2O + O2 → 2N+4O2
4. Tính chất hóa học của H2
Hiđro là phi kim có tính khử. Ở những nhiệt độ thích hợp, hiđro không những kết hợp được với đơn chất oxi mà còn kết hợp được với nguyên tố oxi trong một số oxit kim loại. Các phản ứng này đều tỏa nhiều nhiệt. Cụ thể:
– Hiđro tác dụng với oxi
Hiđro cháy trong oxi theo phương trình hóa học:
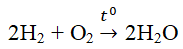
Hỗn hợp H2 và O2 là hổn hợp nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ H2 : O2 là 2:1 về thể tích.
– Hiđro tác dụng với một số oxit kim loại như FeO, CuO, Fe2O3, …
Ví dụ:
Hiđro phản ứng với đồng oxit ở nhiệt độ khoảng 400°C theo phương trình hóa học:
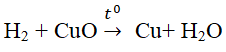
5. Bài tập vận dụng liên quan
Câu 1. Khi có tia lửa điện hoặc ở nhiệt độ cao, nitơ tác dụng trực tiếp với ôxi tạo ra hợp chất X. Công thức của X là
A. N2O.
B. NO2.
C. NO.
D. N2O5.
Lời giải:
Câu 2. Nitơ thể hiện tính khử trong phản ứng với chất nào sau đây ?
A. H2.
B. O2.
C. Mg.
D. Al.
Lời giải:
Câu 3. Phần trăm khối lượng của N trong một oxit của nó là 30,43%.Tỉ khối của A so với He bằng 23. Xác định CTPT của oxit đó là:
A. N2O
B. N2O4
C. N2O5
D. NO2
Lời giải:
Phân tử khối của A là 46. Gọi công thức của oxit là NxOy
Có %N/%O = 14x/16y = 30,4369,57
suy ra xy = 12 → Công thức đơn giản nhất là NO2
Mà MA = 46→ A là NO2
Câu 4. Trong các oxit của nito thì oxit được điều chế trực tiếp từ phản ứng của nitơ với oxi là:
A. NO2
B. NO
C. N2O
D. N2O5
Lời giải:
Xem thêm các phương trình hóa học khác:
N2 + O2 → NO
NO + O2 → NO2
NH3 + HNO3 → NH4NO3
NH3 + Cl2 → N2 + NH4Cl
NH3 + O2 → NO + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




