Phản ứng NaHSO3 + NaOH → Na2SO3 + H2O
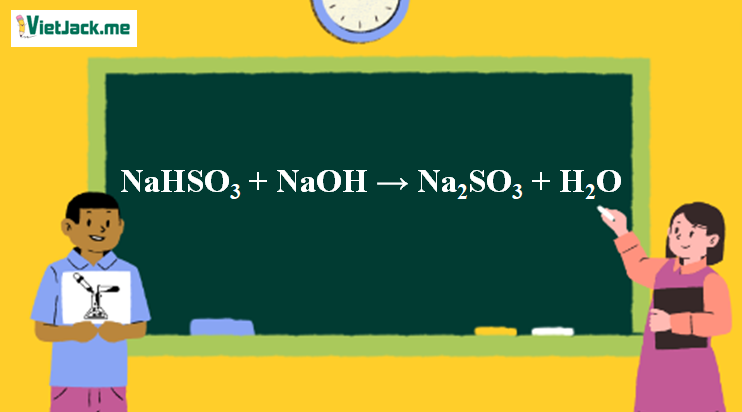
1. Phương trình phản ứng NaHSO3 ra Na2SO3
NaHSO3 + NaOH → Na2SO3 + H2O
2. Phương trình ion rút gọn NaHSO3 + NaOH
Phương trình ion rút gọn:
HSO3− + OH− → SO32− + H2O
3. Điều kiện phản ứng NaHSO3 ra Na2SO3
Không có
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của NaHSO3 (Natri hidrosunfit)
NaHSO3 tác dụng với bazo tạo thành muối mới và nước.
4.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh tác dụng được với muối.
5. Tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
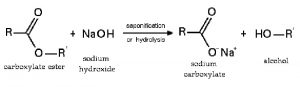
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
6. Tính chất hoá học của NaHSO3
6.1. NaHSO3 tác dụng với kim loại
Zn + 2NaHSO3 ⟶ Zn(OH)2 + Na2S2O4
6.2. NaHSO3 bị phân huỷ tạo thành nước, khí cacbonic và muối của Na
2NaHSO3 ⟶ H2O + Na2S2O5
4NaHSO3 ⟶ 2H2O + O2 + 2Na2S2O4
2NaHSO3 → H2O + Na2SO3 + SO2
6.3. NaHSO3 tác dụng với bazo
NaOH + NaHSO3 ⟶ H2O + Na2SO3
Ba(OH)2 + 2NaHSO3 → 2H2O + Na2SO3 + BaSO3
6.4. NaHSO3 phản ứng với Phenol
C6H5OH + NaHSO3 → C6H5ONa + H2O + SO2
6.5 NaHSO3 tác dụng với axit
Natri Bisunfit tác dụng với axit sẽ sinh ra khí SO2 có mùi hắc và làm sủi bọt khí
HCl + NaHSO3 ⟶ H2O + NaCl + SO2
H2SO4 + NaHSO3 → H2O + SO2 + NaHSO4
6.6. NaHSO3 tác dụng với dung dịch NaClO loãng (thuốc tẩy Clo)
Phản ứng làm giảm thiếu hơi độc
NaClO + NaHSO3 → NaCl + NaHSO4
6.7. Tác dụng với một số chất khác
MnO2 + 2NaHSO3 ⟶ H2O + MnO + Na2S2O6
Cl2 + H2O + NaHSO3 ⟶ 2HCl + NaHSO4
7. Ứng dụng NaHSO3
– Natri Bisunfit được sử dụng với vai trò là một chất khử trong ngành sản xuất thuốc nhuộm, giấy, thuộc da, công nghiệp tổng hợp hóa học.
– Được dùng trong ngành công nghiệp dược phẩm để sản xuất dipyrone và trung gian aminopyrine.
– NaHSO3 là chất tẩy rửa, làm trắng, chất bảo quản, chất chống oxy hóa trong quá trình đóng hộp, chế biến thực phẩm
– Dùng NaHSO3 để duy trì điều kiện kỵ khí trong vòng một lò phản ứng.
– Natri Bisunfit xử lý nước thải công nghiệp có chứa Crom, Clo trước khi thải ra môi trường. Ngăn ngừa sự ăn mòn oxi hoá trong các hệ thống ống dẫn lớn.
8. Bài tập vận dụng
Câu 1. Dãy các chất nào sau đây là muối axit?
A. Mg(HCO3)2, Ba(HCO3)2, CaSO3.
B. Ba(HCO3)2, NaHSO3, Ca(HCO3)2.
C. Ca(HCO3)2, Ba(HCO3)2, BaCO3.
D. NaHSO3, BaCO3, Na2SO3.
Lời giải:
Đáp án: B
Câu 2. Dãy gồm toàn muối trung hòa là?
A. KOH, NaCl, Na2SO4
B. Mg(NO3)2, FeS, CaSO3
C. NaHS, K3PO4, KCl
D. HNO3, KCl, CaCO3
Lời giải:
Đáp án: B
Câu 3. Dung dịch nào sau đây làm quì tím chuyển sang màu đỏ?
A. NH4Cl
B. KOH
C. K2SO3
D. Na2CO3
Lời giải:
Đáp án: A
Câu 4. Nhận định nào sau đây về muối axit là đúng nhất:
A. Muối có khả năng phản ứng với bazơ.
B. Muối vẫn còn hiđro trong phân tử.
C. Muối tạo bởi axit yếu và bazơ mạnh.
D. Muối vẫn còn hiđro có thể phân li ra cation H+
Lời giải:
Đáp án: D
Câu 5. Theo thuyết A-re-ni-ut axit là chất
A. khi tan trong nước phân li ra ion OH-
B. khi tan trong nước chỉ phân li ra ion H+
C. khi tan trong nước phân li ra ion H+
D. khi tan trong nước chỉ phân li ra ion OH-
Lời giải:
Đáp án: C
Giải thích:
Câu B sai vì ngoài sinh ra H+ thì phải phân li ra thêm anion để bảo toàn điện tích.
Câu 6. Theo thuyết Areniut, kết luận nào sau đây đúng?
A. Bazơ là chất khi tan trong nước phân li cho anion OH.
B. Bazơ là những chất có khả năng phản ứng với axit.
C. Một Bazơ không nhất thiết phải có nhóm OH trong thành phần phân tử.
D. Bazơ là hợp chất trong thành phần phân tử có một hay nhiều nhóm OH.
Lời giải:
Đáp án: A
Câu 7. Cho các muối sau: NaHCO3; NaHSO4; Na2HPO3; NaHSO3; (NH4)2CO3; Na2HPO4. Số muối axit là:
A. 3
B. 4
C. 5
D. 6
Lời giải:
Đáp án: B
Giải thích:
Số muối axit là : NaHCO3; NaHSO4; NaHSO3; Na2HPO4
+ NH4+ là cation như một cation kim loại chứ không phải gốc axit
+ HPO32- không phân li ra H+ nên Na2HPO3 là muối trung hòa
Câu 8. Cho các chất: Al, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3. Số chất phản ứng được với cả dung dịch HCl và dung dịch NaOH là
A. 4
B. 6
C. 5
D. 7
Lời giải:
Đáp án: B
Giải thích:
Các chất phản ứng được với cả dung dịch HCl và dung dịch NaOH là Al, Al2O3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3
Xem thêm các phương trình phản ứng hóa học khác:
K2CO3 + HCl → KCl + CO2 + H2O
KClO3 + HCl → Cl2 + KCl + H2O
KClO3 → KCl + O2
BaCl2 + H2SO4 → BaSO4 + HCl
Ba(OH)2 + H2SO4 → BaSO4 + H2O
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




