Phản ứng: NaOH + AlCl3 dư → Al(OH)3 + NaCl
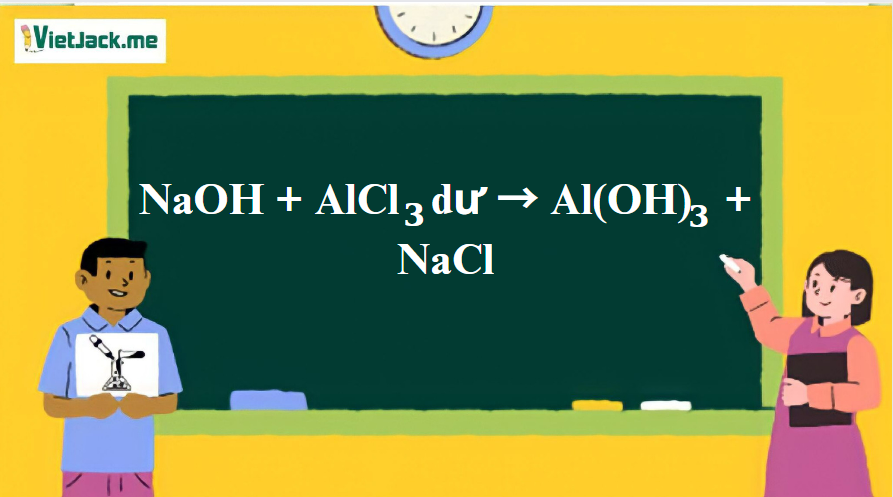
1. Phương trình phản ứng giữa NaOH và AlCl3 dư
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
2. Cách tiến hành phản ứng cho NaOH tác dụng với AlCl3 dư
– Nhỏ từ từ đến dư AlCl3 vào ống nghiệm chứa sẵn 1 – 2 ml dung dịch NaOH.
3. Hiện tượng phản ứng cho NaOH tác dụng với AlCl3 dư
– Xuất hiện kết tủa keo trắng.
4. Bản chất của các chất tham gia phản ứng
4.1 Bản chất của NaOH
NaOH là một bazo mạnh nên tác dụng được với muối AlCl3.
4.2 Bản chất của AlCl3
AlCl3 mang đầy đủ tính chất hoá học của muối nên tác dụng được với dung dịch bazo.
5. Tính chất hóa học của NaOH
5.1 Làm đổi màu chất chỉ thị
Dung dịch NaOH làm quỳ tím chuyển thành màu xanh.
Dung dịch NaOH làm phenolphthalein không màu chuyển sang màu đỏ, đổi màu methyl da cam thành màu vàng.
5.2 Natri hidroxit tác dụng với oxit axit
Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
Phản ứng với oxit axit: NO2, SO2, CO2…
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
NaOH + SO2→ NaHSO3
2NaOH + 2NO2→ H2O + NaNO2 + NaNO3 (tạo 2 muối )
NaOH + CO2 → NaHCO3
2NaOH + CO2→ Na2CO3 + H2O
3NaOH + P2O5 → Na3PO4↓ + 3H2O
NaOH + SiO2 → Na2SiO3
Phản ứng với SiO2 là phản ứng ăn mòn thủy tinh vì thế khi nấu chảy NaOH, người ta dùng các dụng cụ bằng sắt, niken hay bạc mà không dùng thủy tinh để chứa NaOH.
5.3 Natri hidroxit tác dụng với axit
Là một bazơ mạnh nên tính chất đặc trưng của NaOH là tác dụng với axit tạo thành muối tan và nước. Phản ứng này còn gọi là phản ứng trung hòa.
Ví dụ:
NaOH + HCl → NaCl+ H2O
NaOH + HNO3→ NaNO3+ H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
3NaOH + H3PO4→ Na3PO4 + 3H2O
2NaOH + H2CO3 → Na2CO3 + 2H2O
5.4 Natri hidroxit tác dụng với muối
Natri hidroxit tác dụng với dung dịch muối tạo thành muối mới và bazơ mới.
Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2⏐↓
NaOH + MgSO4→ Mg(OH)2 + Na2SO4
2NaOH + MgCl2 → 2NaCl + Mg(OH)2
FeCl3 + 3NaOH → Fe(OH)3+ 3NaCl
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓ nâu đỏ
5.5 Natri hidroxit tác dụng với một số phi kim như Si, C, P, S, Halogen
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
C + NaOH nóng chảy → 2Na + 2Na2CO3 + 3H2↑
4P trắng + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
Cl2+ 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH → NaCl + NaClO3 + 3H2O
5.6 Dung dịch NaOH có khả năng hoà tan một hợp chất của kim loại lưỡng tính Al, Zn, Be Sn Pb
Ví dụ: Al, Al2O3, Al(OH)3
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3→ 2NaAlO2 + H2O
NaOH + Al(OH)3→ NaAlO2 + 2H2O
Chất được tạo ra trong dung dịch có thể chứa ion Na[Al(OH)4], hoặc có thể viết
Al(OH)3 + NaOH → Na[Al(OH)4]
Tương tự, NaOH có thể tác dụng với kim loại Be, Zn, Sb, Pb, Cr và oxit và hiđroxit tương ứng của chúng.
6. Ứng dụng của NaOH
– Sản xuất các sản phẩm làm sạch và khử khuẩn. …
– Ứng dụng trong ngành Y học – Dược phẩm. …
– Ứng dụng trong chế tạo nguyên liệu, năng lượng. …
– Sử dụng trong xử lý nước. …
– Ứng dụng trong chế biến thực phẩm. …
– Ứng dụng trong sản phẩm gỗ và giấy. …
– Ứng dụng trong sản xuất công nghiệp khác.
7. Bài toán về sự lưỡng tính của Al(OH)3
Al(OH)3 là hiđroxit lưỡng tính:
+ Tác dụng với axit mạnh: Al(OH)3 + 3HCl → AlCl3 + 3H2O
+ Tác dụng với dung dịch kiềm mạnh: Al(OH)3 + KOH → KAlO2 + 2H2O
Hay: Al(OH)3 + KOH → K[Al(OH)4]
Phương trình ion thu gọn: Al(OH)3 + OH– → AlO2– + 2H2O
6.1: Cho dung dịch OH– tác dụng với dung dịch Al3+
Phương pháp giải:
Quá trình phản ứng
Al3++3OH−→Al(OH)3
Al(OH)3+OH−→AlO2−+2H2O
Cách 1: Tính theo phương trình hóa học.
Cách 2: Xét tỉ lệ k=nOH−nAl3+
Nếu k ≤ 3 thì khi đó nAl(OH)3=nOH−3
Nếu 3 < k < 4 thì khi đó nAl(OH)3=4nAl3+−nOH−
Cách 3: Ta có thể dùng sơ đồ phản ứng kết hợp với phương pháp bảo toàn nguyên tố, bảo toàn điện tích để giải nhanh.
6.2: Cho từ từ dung dịch H+ vào dung dịch AlO2−
Phương pháp giải:
Cách 1: Tính theo phương trình hóa học nối tiếp
Khi cho muối aluminat tác dụng với dung dịch axit xảy ra phản ứng:
AlO2−+H++H2O→Al(OH)3
Nếu H+ dư thì xảy ra tiếp:
Al(OH)3+3H+→Al3++3H2O
Chú ý: Nếu trong dung dịch có OH– thì H+ sẽ phản ứng với OH– trước, sau đó mới phản ứng với AlO2−
Cách 2: Xét phương trình hóa học song song
AlO2−+H++H2O→Al(OH)3(1)
AlO2−+4H+→Al3++2H2O(2)
Nếu nH+≤nAlO2− thì chỉ xảy ra (1), khi đó: nAl(OH)3=nH+
Nếu nH+>nAlO2− thì xảy ra cả (1) và (2), khi đó nH+=nAl(OH)3+4nAl3+nAlO2−=nAl(OH)3+nAl3+
Cách 3: Dùng bảo toàn nguyên tố.
8. Bài tập vận dụng liên quan
Câu 1: Cho 100 ml dung dịch AlCl3 0,15M vào 250 ml dung dịch NaOH 0,2M, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
A. 1,56 B. 0,78
C. 1,17 D. 1,30
Hướng dẫn giải
Đáp án B
nAlCl3=0,015mol→nAl3+=0,015mol
nNaOH=0,05mol→nOH−=0,05mol
Phương trình hóa học:
Al3++3OH−→Al0,015→0,045→0,015
Sau phản ứng, OH– dư: 0,05 – 0,045 = 0,005 mol
Al+OH−→AlO2−+2H2O0,005←0,005
Sau phản ứng: nAl(OH)3=0,015−0,005=0,01mol
→ mkết tủa = 0,01.78 = 0,78 gam
Câu 2: Cho từ từ đến hết 100 ml dung dịch NaOH 1,5M vào 50 ml dung dịch AlCl3 1,5M, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
A. 12,4. B. 7,8.
C. 15,6. D. 3,9.
Hướng dẫn giải
Đáp án D
nNaOH=0,15mol→nOH−=0,15mol
nAlCl3=0,075mol→nAl3+=0,075mol
Xét tỉ lệ nOH−nAl3+=2<3
Khi đó nAl(OH)3=nOH−3=0,153=0,05mol→m=mAl(OH)3=0,05.78=3,9gam
Câu 3: Cho 200 ml dung dịch HCl 2M vào 100 ml dung dịch gồm NaOH 0,6M và NaAlO2 1M, phản ứng xong thu được m gam kết tủa. Giá trị của m là
A. 7,80. B. 3,90.
C. 3,12. D. 1,56.
Hướng dẫn giải
Đáp án D
nHCl=0,4mol→nH+=0,4mol
nNaOH=0,06mol→nOH−=0,06mol
nNaAlO2=0,1mol→nAlO2−=0,1mol
Phương trình hóa học:
OH−+H+→H2O0,06→0,06
AlO2−+H++H2O→Al0,1→0,1→0,1
Al+3H+→Al3++3H2O0,08←0,24
Ta có: nAl(OH)3du=0,1−0,08=0,02mol→mAl(OH)3du=0,02.78=1,56gam
Câu 4: Cho 100 ml dung dịch HCl 0,5M vào 100 ml dung dịch NaAlO2 1M, phản ứng xong thu được m gam kết tủa. Giá trị của m là
A. 3,90 B. 7,80.
C. 5,85. D. 4,68.
Hướng dẫn giải
Đáp án A
nHCl=0,05mol→nH+=0,05mol
nNaAlO2=0,1mol→nAlO2−=0,1mol
Ta thấy nH+<nAlO2− nên khi đó nAl(OH)3=nH+=0,05mol
→m=mAl(OH)3=0,05.78=3,9gam
Câu 5:Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3 ?
A.Dung dịch NaOHB.Dung dịch Ba(OH)2
C.Dung dịch NH3D.Dung dịch nước vôi trong
Hướng dẫn giải
Đáp án C
Khi cho NH3 vào 2 dung dịch cả 2 dung dịch đều xuất hiện kết tủa hiđroxit, nhưng Zn(OH)2 tạo thành có khả năng tạo phức với NH3 nên kết tủa lại tan, còn với Al(OH)3 không tan trong NH3
Al(NO3)3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4NO3
Zn(NO3)2 + 2NH3 + 2H2O → Zn(OH)2↓ + 2NH4NO3
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn), tạo thành các dung dịch phức chất.
Câu 6: Hiện tượng nào xảy ra khi cho từ từ đến dư dung dịch NaOH vào dung dịch AlCl3?
A. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện
B. Xuất hiện kết tủa keo trắng ngay lập tức, sau đó kết tủa tan dần
C. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện, rồi tan dần.
D. Xuất hiện kết tủa keo trắng ngay lập tức và không tan.
Hướng dẫn giải
Đáp án B
Ban đầu có kết tủa keo trắng ngay lập tức
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
Khi NaOH dư, kết tủa tan dần
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Câu 7:Nhôm hiđroxit thu được từ cách làm nào sau đây?
A. Cho dư dung dịch HCl vào dung dịch natri aluminat.
B. Thổi dư CO2 vào dung dịch natri aluminat.
C. Cho dư dung dịch NaOH vào dung dịch AlCl3.
D. Cho Al2O3 tác dụng với nướC.
Hướng dẫn giải
Đáp án B
Nhôm hiđroxit thu được khi thổi dư CO2 vào dung dịch natri aluminat
Phương trình phản ứng:
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3.
Câu 8: Cho hỗn hợp X gồm Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02. Cho X tan trong dung dịch NaOH vừa đủ thu được dung dịch Y và 0,672 lít khí H2 (đktc). Cho Y tác dụng với 200 ml dung dịch HCl được kết tủa Z. Nung Z ở nhiệt độ cao đến khối lượng không đổi được 3,57g chất rắn. Nồng độ mol của dung dịch HCl là
A. 0,35M hoặc 0,45M. B. 0,07M hoặc 0,11M.
C. 0,07M hoặc 0,09M. D. 0,35M hoặc 0,55M.
Hướng dẫn giải
Đáp án D
nH2= 0,03
Bảo toàn electron: 3.nAl = 2.nH2
→ nAl = 0,02 → mAl = 0,54g
Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02
→mAl2O3= 0,540,18.1,02=3,06g
→nAl2O3bđ = 0,03 mol
Bảo toàn nguyên tố Al →nNaAlO2 = nAl + 2. nAl2O3 bđ = 0,08 mol
nAl2O3thu được = 3,57 : 102 = 0,035 mol
nAl(OH)3= 0,07 mol
Trường hợp 1: NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
nHCl = nAl(OH)3 = 0,07 mol
→ CM HCl = 0,070,2= 0,35M
Trường hợp 2:
NaAlO2+HCl+H2O→AlOH3+NaCl0,07←0,07←0,07mol
NaAlO2+4HCl→AlCl3+NaCl+2H2O(0,08−0,07)→0,04mol
→ nHCl = 0,11 mol
→ CM HCl = 0,110,2 = 0,55M
Câu 9:Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch
A.NaOH. B. HCl.
C.NaNO3 D. H2SO4.
Hướng dẫn giải
Đáp án A
Trích mẫu thử của hai dung dịch ra hai ống nghiệm có đánh số.
Nhỏ NaOH dư vào từng ống nghiệm
– Xuất hiện kết tủa trắng sau đó kết tủa tan: AlCl3
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
– Không có hiện tượng gì: KCl
Câu 10: Cho 3,24 gam Al2(SO4)3 phản ứng với 25 ml dung dịch NaOH thu được 0,78 gam kết tủa trắng. Nồng độ mol của dung dịch NaOH đã dùng là
A. 1,2M và 2,4M. B. 1,2M.
C. 2,8M. D. 1,2M và 2,8M.
Hướng dẫn giải
Đáp án D
nAl2(SO4)3 = 0,01 mol → nAl3+ = 2.nAl2(SO4)3 = 0,02 mol
mà nAl(OH)3= 0,7878 = 0,01 mol < 0,02 nên có 2 trường hợp
Trường hợp 1: nOH−min = 3.nAl(OH)3 = 0,03 mol
→ CM NaOH = 0,030,025 = 1,2M.
Trường hợp 2: nOH−max = 4.nAl3+ – nAl(OH)3 = 4.0,02 – 0,01 = 0,07 mol
→ CM NaOH = 0,070,025 = 2,8M
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




