Phản ứng: AlCl3 + NaOH → Al(OH)3↓ + NaCl
1. Phương trình phản ứng giữa AlCl3 và NaOH
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl
2. Điều kiện phản ứng
– Điều kiện thường
3. Cách thực hiện phản ứng
– Nhỏ từ từ dung dịch NaOH vào dung dịch AlCl3
4. Hiện tượng nhận biết phản ứng
– Có kết tủa keo trắng xuất hiện.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của AlCl3
Trong phản ứng này, AlCl3 là một muối axit, Al3+ sẽ tác dụng với OH- để tạo ra Al(OH)3
5.2 Bản chất của NaOH
– Trong phản ứng này, NaOH là một bazo, NaOH sẽ tác dụng với ion Cl- của AlCl3 để tạo ra NaCl.
6. Tính chất hóa học của AlCl3
– Mang đầy đủ tính chất hóa học của muối
6.1 Tác dụng với dung dịch bazo:
AlCl3 + NaOH(vừa đủ) → NaCl + Al(OH)3
6.2 Tác dụng với dung dịch muối khác:
AlCl3 + AgNO3 → AgCl↓ + NaNO3
6.3 Phản ứng với kim loại mạnh hơn:
3Mg + 2AlCl3 → 3MgCl2 + 2Al
7. Tính chất hóa học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
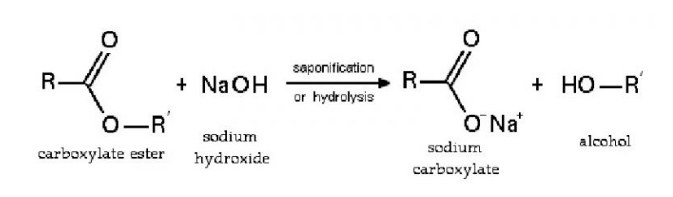
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
8. Ứng dụng của NaOH
– Sản xuất các sản phẩm làm sạch và khử khuẩn. …
– Ứng dụng trong ngành Y học – Dược phẩm. …
– Ứng dụng trong chế tạo nguyên liệu, năng lượng. …
– Sử dụng trong xử lý nước. …
– Ứng dụng trong chế biến thực phẩm. …
– Ứng dụng trong sản phẩm gỗ và giấy. …
– Ứng dụng trong sản xuất công nghiệp khác.
9. Bạn có biết
– Nếu NaOH dư, kết tủa Al(OH)3 sẽ tan theo PTHH
NaOH + Al(OH)3↓ → NaAlO2 (dd) + 2H2O
– Các dung dịch muối nhôm khác cũng có phản ứng với NaOH tương tự AlCl3.
10. Bài tập vận dụng
Câu 1. Cho từ từ dung dịch NaOH đến dư vào dung dịch AlCl3 thấy xuất hiện
A. kết tủa màu xanh.
B. kết tủa keo trắng, sau đó kết tủa không tan.
C. kết tủa keo trắng, sau đó kết tủa tan dần.
D. kết tủa màu nâu đỏ.
Lời giải:
Câu 2. Phát biểu nào sau đây là sai?
A. Cho NaOH dư vào dung dịch AlCl3 có xuất hiện kết tủa trắng, sau đó kết tủa tan dần
B. Al(OH)3, Al2O3, Al đều là các chất lưỡng, tính,
C. Nhôm là kim loai nhẹ và có khả năng dẫn điện Iot
D. Từ Al2O3 có thế điều chế được Al.
Lời giải:
Câu 3. Cho từ từ AlCl3 vào dung dịch X thu được kết tủa keo trắng. Chất X là
A. HCl.
B. NH3.
C. NaOH.
D. KOH.
Lời giải:
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




