Phản ứng NH3 + AlCl3 + H2O → Al(OH)3↓keo trắng + NH4Cl
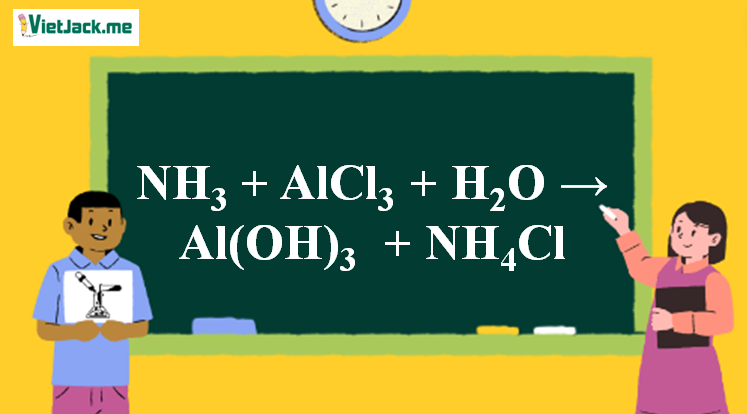
1. Phương trình phản ứng NH3 tác dụng với AlCl3
2NH3 + AlCl3 + 3H2O → Al(OH)3↓keo trắng + 3NH4Cl
2. Điều kiện phản ứng NH3 tác dụng AlCl3
Nhiệt độ thường
3. Phương trình ion rút gọn NH3 + AlCl3
Phương trình phản tử NH3 + AlCl3
2NH3 + AlCl3 + 3H2O → Al(OH)3 ↓keo trắng + 3NH4Cl
Phương trình ion rút gọn:
Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của NH3 (Amoniac)
NH3 mang tính chất của một bazo yếu tác dụng với dung dịch muối của các kim loại mà hidroxit không tan tạo bazo và muối.
4.2. Bản chất của AlCl3 (Nhôm clorua)
AlCl3 mang đầy đủ tính chất hoá học của muối tác dụng với dung dịch bazo.
5. Cách tiến hành điều chế Al(OH)3 và thử tính chất của Al(OH)3
Sục khí NH3 tới dư vào dung dịch AlCl3
Điều chế Al(OH)3 trong 2 ống nghiệm bằng cách cho dung dịch muối nhôm tác dụng với dung dịch amoniac:
2NH3+ AlCl3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl
Al3+ + 3NH3+ 3H2O → Al(OH)3 + 3NH4+
Cho từng giọt HCl đến dư vào ống nghiệm thứ nhất, thấy kết tủa tan ra.
Al(OH)3 + HCl → AlCl3 + 3H2O
Cho từng giọt dung dịch kiềm mạnh NaOH đến dư vào ống nghiệm thứ hai, thấy kết tủa cũng tan ra.
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Kết luận: Al(OH)3 thể hiện tính bazo trội hơn tính axit.
6. Hiện tượng phản ứng xảy ra khi sục khí NH3 tới dư vào dung dịch AlCl3
Dung dịch amoniac tác dụng với dung dịch muối nhôm clorua tạo thành kết tủa nhôm hiđroxit có màu trắng Al(OH)3.
7. Tính chất hoá học của NH3
7.1. Tính bazơ yếu
– Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH–
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
– Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
– Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (amoni clorua)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
7.2. Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
7.3. Tính khử
– Amoniac có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
– Tác dụng với oxi:
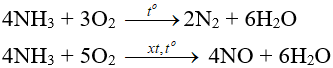
– Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
– Tác dụng với CuO:
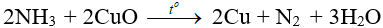
7.4. Điều chế NH3
– Trong phòng thí nghiệm
2NH4Cl + Ca(OH)2 → NH3 + CaCl2 + H2O
– Trong công nghiệp
NH3 được cấu tạo từ azot và hydro liên kết với nhau. Azot được thu từ không khí còn hydro được tạo thành từ nước. Sau khi được sấy khô, hâm nóng và nén ở 530 o C, hỗn hợp này (azot, hydro) được cho qua các liên kết muối khác nhau để tạo thành amoniac.
8. Mở rộng kiến thức về AlCl3
8.1. Tính chất vật lí & nhận biết
– Tính chất vật lí: Là hợp chất có màu trắng, tan được trong nước, nhiệt độ nóng cháy và nhiệt độ sôi thấp.
– Nhận biết: Cho dung dịch nhôm clorua tác dụng với dung dịch AgNO3, thấy xuất hiện kết tủa trắng:
AlCl3 + AgNO3 → AgCl↓ + NaNO3
8.2. Tính chất hóa học
Mang đầy đủ tính chất hóa học của muối
– Tác dụng với dung dịch bazo:
AlCl3 + NaOH(vừa đủ) → NaCl + Al(OH)3
– Tác dụng với dung dịch muối khác:
AlCl3 + AgNO3 → AgCl↓ + NaNO3
– Phản ứng với kim loại mạnh hơn:
3Mg + 2AlCl3 → 3MgCl2 + 2Al
8.3. Điều chế
– Cho nhôm phản ứng với axit HCl:
2Al + 6HCl → 2AlCl3 + 3H2
– Cho nhôm tác dụng với clo
2Al + 3Cl2 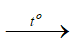 2AlCl3
2AlCl3
9. Bài tập vận dụng liên quan
Câu 1. Thực hiện thí nghiệm sục khí NH3 tới dư vào dung dịch AlCl3 sau phản ứng có hiện tượng
A. Thu được dung dịch trong suốt
B. Xuất hiện kết tủa trắng
C. Xuất hiện kết tủa nâu đỏ
D. Xuất hiện khí có mùi khai
Lời giải:
Dẫn NH3 vào dung dịch AlCl3 có phản ứng hóa học sau:
AlCl3+ 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl
Vì NH3 là bazo yếu nên không thể hòa tan được hidroxit Al(OH)3
Sau phản ứng Có kết tủa keo trắng không tan
Câu 2. Dung dịch NH3 có thể hòa tan được Zn(OH)2 là do:
A. Do Zn(OH)2 là một bazo ít tan
B. Do Zn(OH)2 có khả năng tạo thành phức chất tan
C. Do Zn(OH)2 là một bazo lưỡng tính
D. Do NH3 là một hợp chất có cực và là một bazo yếu
Lời giải:
Do Zn(OH)2 có khả năng tạo thành phức chất tan: Zn(NH3)4(OH)2 tan
Zn(OH)2 + NH3→ [Zn (NH3)4](OH)2
Câu 3. Khi dẫn khí NH3 vào bình chứa Cl2 thì phản ứng tạo ra khói trắng. Hợp chất tạo thành có công thức là?
A. N2
B. NH3
C. NH4Cl
D. HCl
Lời giải:
Phương trình phản ứng minh họa
2NH3 + 3Cl2 → N2 + 6HCl
NH3 khí + HCl khí → NH4Cl (khói trắng)
Câu 4. A là muối khi tác dụng với dung dịch NaOH dư sinh khí mùi khai, tác dụng với dung dịch BaCl2 sinh kết tủa trắng không tan trong HNO3. X là muối nào trong số các muối sau?
A. (NH4)2CO3.
B. (NH4)2SO3.
C. NH4HSO3.
D. (NH4)3PO4.
Lời giải:
X + NaOH dư sinh ra khí mùi khai ⟹ khí mùi khai là NH3 ⟹ X có chứa muối amoni (NH4+)
X + BaCl2 sinh ra kết tủa không tan trong HNO3 ⟹ kết tủa này phải tạo bởi kim loại mạnh và gốc axit mạnh ⟹ kết tủa là BaSO4
Kết hợp với đáp án ⟹ X là: NH4HSO4
Phương trình hóa học:
NH4HSO4 + 2NaOH → Na2SO4 + NH3↑ (mùi khai) + 2H2O
NH4HSO4 + BaCl2 → BaSO4↓ + NH4Cl + HCl
Câu 5. Cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
A. Dung dịch KCl.
B. Dung dịch NaOH.
C. Dung dịch phenolphtalein
D. Dung dịch Ba(OH)2.
Lời giải:
Trích mẫu thử và đánh số thứ tự
Sử dụng dung dịch NaOH để nhận biết các dung dịch trên
Nhỏ dung dịch NaOH lần lượt vào 3 ống nghiệm đã được đánh số thứ tự trước đó
Ống nghiệm nào xuất hiện khí mùi khai thì dung dịch ban đầu là NH4Cl
NH4Cl + NaOH → NH3 + H2O + NaCl
Ống nghiệm nào xuất hiện kết tủa keo trắng thì dung dịch ban đầu là Ba(HCO3)2
2NaOH + Ba(HCO3)2→ BaCO3 + Na2CO3+ 2H2O
Ống nghiệm không xuất hiện, hiện tượng gì là dung dịch còn lại
Câu 6. Cho NH3 dư vào 100ml dung dịch gồm CuSO4 1M ; ZnCl2 0,5M, AgNO3 1M và AlCl3 1M. Khối lượng kết tủa sau phản ứng là
A. 9,8 gam
B. 4,9 gam
C. 7,8 gam
D. 5 gam
Lời giải:
Vì các ion Cu2+, Zn2+, Ag+ tạo kết tủa với NH3, sau đó kết tủa tan trong NH3 dư tạo phức
=> kết tủa thu được chỉ gồm Al(OH)3
nAl(OH)3= nAlCl3= 0,1 mol => m = 7,8 gam
Câu 7. Có 4 dung dịch mất nhãn sau: NH4Cl, NH4HCO3, NaNO3, MgCl2. Dùng hóa chất có thể dùng phân biệt 4 dung dịch trên với 1 lượt thử duy nhất là:
A. dung dịch Ca(OH)2
B. dung dịch KOH
C. dung dịch Na2SO4
D. dung dịch HCl
Lời giải:
Khi cho Ca(OH)2 vào 4 dung dịch: NH4Cl, NH4HCO3, NaNO3, MgCl2
Mẫu thử xuất hiện khí mùi khai NH3, hóa chất ban đầu là NH4Cl
2NH4Cl + Ca(OH)2→ CaCl2 + 2NH3 ↑ + 2H2O
Mẫu thử xuất hiện kết tủa trắng Mg(OH)2, hóa chất ban đầu là Mg(NO3)2
Mg(NO3)2 + Ca(OH)2 → Ca(NO3)2 + Mg(OH)2
Mẫu thử xuất hiện kết tủa trắng Al(OH)3 sau kết tủa tan Ba(AlO2)2, hóa chất ban đầu là Al(NO3)3
2Al(OH)3 + Ba(OH)2→ Ba(AlO2)2 + 4H2O
Mẫu thử xuất hiện kết tủa trắng BaCO3 và khí mùi khai NH3, hóa chất ban đầu là Al(NO3)3
Mẫu thử không có hiện tượng gì, hóa chất ban đầu là NaCl
Câu 8. Cho 2,92 gam hỗn hợp X gồm NH4NO3 và (NH4)2SO4 tác dụng vừa đủ với 400 ml dung dịch NaOH thu được 0,896 lít khí.Tìm pH của dung dịch NaOH đã dùng.
A.11
B.12
C.13
D.14
Lời giải:
Theo đề bài ta có:
nNH4NO3 = 0,02 mol;
n(NH4)2SO4 = 0,01 mol
=> nNaOH = 0,02 + 0,01.2 = 0,04 mol
→ CM(NaOH) = 0,040,4 = 0,1 => pH =13
Câu 9. So sánh nào dưới đây không đúng?
A. Fe(OH)2 và Cr(OH)2 đều là bazơ và là chất khử.
B. Al(OH)3 và Cr(OH)3 đều là chất lưỡng tính và vừa có tính oxi hóa vừa có tính khử.
C. H2SO4 và H2CrO4 đều là axit có tính oxi hóa mạnh.
D. BaSO4 và BaCrO4 đều là những chất không tan trong nước.
Lời giải:
So sánh nào dưới đây không đúng?
A đúng Fe(OH)2 và Cr(OH)2 đều là bazơ và là chất khử.
B đúng Al(OH)3 và Cr(OH)3 đều là chất lưỡng tính và vừa có tính oxi hóa vừa có tính khử.
C đúng H2SO4 và H2CrO4 đều là axit có tính oxi hóa mạnh.
D sai vì BaCrO4 không tan trong nước.
Câu 10. Trường hợp nào sau đây xảy ra ăn mòn điện hóa?
A. Sợi bạc nhúng trong dung dịch HNO3.
B. Đốt lá sắt trong khí Cl2.
C. Thanh nhôm nhúng trong dung dịch H2SO4 loãng.
D. Thanh kẽm nhúng trong dung dịch CuSO4.
Lời giải:
A Sai vì Sợi bạc nhúng trong dung dịch HNO3 là phản ứng oxi hóa khử
B Sai vì Đốt lá sắt trong khí Cl2 phản ứng cháy
C Sai
D đúng
Câu 11. Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3 hiện tượng xảy ra là
A. Có kết tủa keo trắng, sau đó kết tủa tan.
B. Chỉ có kết tủa keo trắng.
C. Có kết tủa keo trắng và khí bay lên.
D. Không có kết tủa, có khí bay lên.
Lời giải:
Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3, ban đầu có kết tủa keo trắng xuất hiện.
3NaOH + AlCl3→ Al(OH)3 ↓ + 3NaCl
Sau đó kết tủa keo trắng tan trong NaOH dư tạo dung dịch trong suốt (vì Al(OH)3 có tính lưỡng tính tan được trong dung dịch axit dư, và kiềm dư)
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Câu 12. Tiến hành các thí nghiệm sau:
(1) Cho dung dịch NaOH vào dung dịch Ba(HCO3)2.
(2) Cho dung dịch NH3 đến dư vào dung dịch AlCl3.
(3) Sục khí CO2 tới dư vào dung dịch NaAlO2 (hoặc Na[Al(OH)4]).
(4) Cho dung dịch AgNO3 vào dung dịch MgCl2.
(5) Sục khí H2S vào dung dịch FeCl2.
(6) Cho Mg vào dung dịch FeCl3 dư.
Sau khi các phản ứng kết thúc, có bao nhiêu thí nghiệm thu được kết tủa?
A. 5
B. 4
C. 3
D. 2
Lời giải:
Phương trình phản ứng hóa học
(1) Ba(HCO3)2 + 2NaOH → BaCO3 ↓+ Na2CO3 + 2H2O
(2) AlCl3 + 3H2O + 3NH3→ Al(OH)3 ↓+ 3NH4Cl
(3) CO2 + 2H2O + NaAlO2→ Al(OH)3↓ + NaHCO3
(4) 2AgNO3 + MgCl2 → 2AgCl ↓+ Mg(NO3)2
(5) Không phản ứng
(6) Mg + 3FeCl3 → MgCl2 + 2FeCl2
Xem thêm các phương trình hóa học khác:
NH4Cl + AgNO3 → NH4NO3 + AgCl
NH4Cl + NaOH → NH3 + H2O + NaCl
NH4Cl + Ca(OH)2 → CaCl2 + NH3 + H2O
NH4Cl + Ba(OH)2 → BaCl2 + NH3 + H2O
NH4Cl → NH3 + HCl
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




