Phản ứng NH4NO3 + Ba(OH)2 → Ba(NO3)2 + NH3↑ + H2O
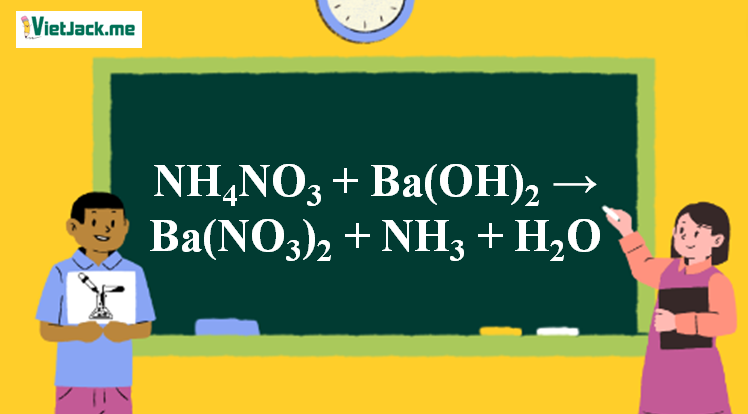
1. Phương trình phản ứng NH4NO3 tác dụng Ba(OH)2
2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3↑ + 2H2O
2. Phương trình ion rút gọn NH4NO3 tác dụng Ba(OH)2
NH4+ + OH− → NH3 + H2O
3. Điều kiện NH4NO3 tác dụng Ba(OH)2
Cho NH4Cl tác dụng với dung dịch NaOH, điều kiện: Nhiệt độ
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của NH4NO3 (Amoni nitrat)
NH4NO3 có thể tác dụng với các bazo như KOH, NaOH, Ba(OH)2,…
4.2. Bản chất của Ba(OH)2 (Bari hidroxit)
Ba(OH)2 là một bazo mạnh tác dụng được với NH4NO3.
5. Hiện tượng phản ứng khi cho NH4NO3 tác dụng Ba(OH)2
Khi cho NH4Cl tác dụng với dung dịch Ba(OH)2, xuất hiện bọt khí có mùi khai do khí Amoniac (NH3) sinh ra.
6. Tính chất hoá học của muối amoni
6.1.Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
6.2. Tác dụng với dung dịch kiềm
(nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
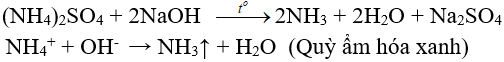
6.3. Phản ứng nhiệt phân
– Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
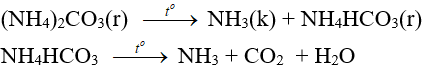
NH4HCO3 (bột nở) được dùng làm xốp bánh.
– Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
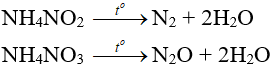
– Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
7. Tính chất hóa học của Ba(OH)2
Mang đầy đủ tính chất hóa học của một bazơ mạnh.
Phản ứng với các axit:
Ba(OH)2 + 2HCl → BaCl2+ 2H2O
Phản ứng với oxit axit: SO2, CO2…
Ba(OH)2 + SO2 → BaSO3 + H2O
Ba(OH)2 + 2SO2 → Ba(HSO3)2
Phản ứng với các axit hữu cơ tạo thành muối:
2CH3COOH + Ba(OH)2 → (CH3COO)2Ba + 2H2O
Phản ứng thủy phân este:
2CH3COOC2H5 + Ba(OH)2 → (CH3COO)2Ba + 2 C2H5OH
Phản ứng với muối:
Ba(OH)2 + CuCl2 → BaCl2 + Cu(OH)2↓
Tác dụng một số kim loại mà oxit, hidroxit của chúng có tính lưỡng tính (Al, Zn…):
Ba(OH)2 + 2Al + 2H2O → Ba(AlO2)2 + 3H2↑
Tác dụng với hợp chất lưỡng tính:
Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2
8. Ứng dụng của muối amoni
Amoni là nguồn nito quan trọng đối với nhiều loài thực vật đặc biệt là đối với những loài mọc trên đất nhiều oxy. Tuy nhiên nó cũng đọc đối với hầu hết các loại cây trồng và hhiếmkhi được sử dụng làm nguôn nito duy nhất. Nito liên kết với protein trong sinh khối chết, được vi sinh vật tiêu thụ chuyển đổi thành các ion amoni ( NH4 + ) có thể được hấp thụ trực tiếp bởi rễ của cây.
Thông qua NH4 + thực vật thủy sinh có thể hấp thụ và kết hợp nito vào protein, axit amin và các phân tử khác. Nồng độ amoni cao có thể làm tăng sự phát triển của tảo và thực vật thủy sinh.
Các muối amoni được sử dụng rộng rãi trong chế biến thực phẩm.
9. Bài tập vận dụng liên quan
Câu 1. Cho quỳ tím vào dung dịch NH3 1M, quỳ tím chuyển sang màu gì?
A. Xanh.
B. Đỏ.
C. Không đổi màu.
D. Hồng.
Lời giải:
Câu 2. Khí N2O là sản phẩm của phản ứng nhiệt phân muối nào sau đây?
A. NaNO3.
B. NH4NO3.
C. NH4NO2.
D. Cu(NO3)2.
Lời giải:
Câu 3. Có 4 dung dịch đựng trong 4 lọ mất nhãn là: (NH4)2SO4, NH4Cl, Na2SO4, KOH. Nếu chỉ được phép sử dụng một thuốc thử để nhận biết 4 dung dịch trên, có thể dùng dung dịch:
A. AgNO3
B. Ba(OH)2
C. KOH
D. BaCl2
Lời giải:
A. NH4H2PO4
B. (NH4)2HPO4
C. (NH4)3PO4
D. NH4H2PO4 và (NH4)2HPO4
Lời giải:
Xem thêm các phương trình hóa học khác:
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
(NH4)2SO4 + BaCl2 → NH4Cl + BaSO4
(NH4)2SO4 + NaOH → Na2SO4 + NH3 + H2O
Pb(OH)2 + NaOH → Na2PbO2 + H2O
KClO3 + C → KCl + CO2
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




