Phản ứng: SO2 + NaOH → Na2SO3 + H2O
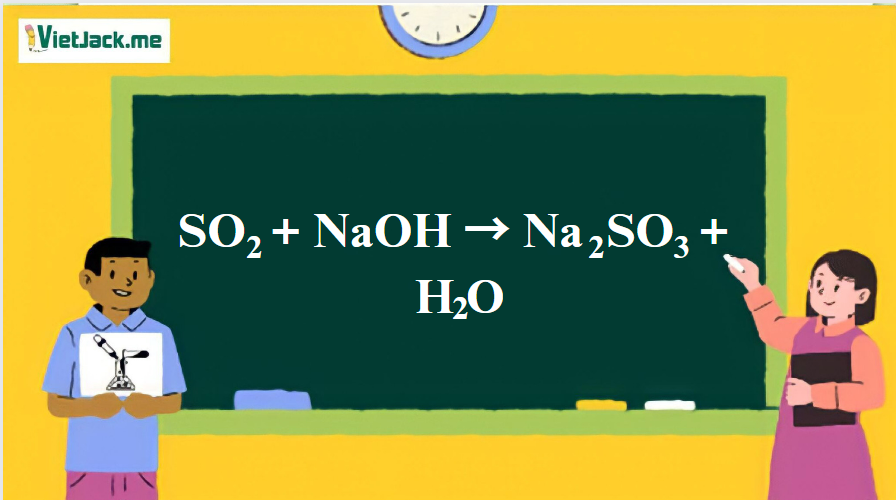
1. Phương trình phản ứng hóa học NaOH + SO2
SO2 + 2NaOH → Na2SO3 + H2O
2. Điều kiện phản ứng SO2 vào dung dịch NaOH
Phản ứng xảy ra ở ngay điều kiện thường.
3. Cách thực hiện phản ứng SO2 vào dung dịch NaOH
Sục khí SO2 vào dung dịch NaOH.
4. Bản chất của các chất tham gia phản ứng
4.1 Bản chất của SO2
– SO2 mang đầy đủ tính chất hóa học của một oxit axit.
– SO2 tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
4.2 Bản chất của NaOH
NaOH tác dụng được với oxit axit
5. Tính chất hóa học của NaOH
5.1. Làm đổi màu chất chỉ thị
Dung dịch NaOH làm quỳ tím chuyển thành màu xanh.
Dung dịch NaOH làm phenolphthalein không màu chuyển sang màu hồng.
5.2. Natri hidroxit tác dụng với oxit axit
2NaOHdư + SO2 → Na2SO3 + H2O
2NaOHdư + CO2 → Na2CO3 + H2O
5.3. Natri hidroxit tác dụng với axit
Là một bazơ mạnh nên tính chất đặc trưng của NaOH là tác dụng với axit tạo thành muối tan và nước. Phản ứng này còn gọi là phản ứng trung hòa.
Ví dụ:
NaOH + HCl → NaCl + H2O
NaOH + HNO3→ NaNO3+ H2O
5.4. Natri hidroxit tác dụng với muối
Natri hidroxit tác dụng với dung dịch muối tạo thành muối mới và bazơ mới.
Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
5.5. Natri hidroxit tác dụng với một số phi kim
Ví dụ:
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
Cl2 + 2NaOH → NaCl + NaClO + H2O
5.6. Một số tính chất khác
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3 → 2NaAlO2 + H2O
NaOH + Al(OH)3 → NaAlO2 + 2H2O
6. Tính chất hóa học của SO2
6.1 Lưu huỳnh đioxit tác dụng với nước:
SO2 + H2O ⇋ H2SO3
6.2 Lưu huỳnh đioxit tác dụng với dung dịch bazơ (có thể tạo thành 2 loại muối sunfit và hiđrosunfit)
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
6.3 Lưu huỳnh đioxit tác dụng với oxit bazơ → muối:
SO2 + CaO → CaSO3
SO2 vừa là chất khử, vừa là chất oxi hóa (do S trong SO2 có mức oxi hóa trung gian +4)
6.4 Lưu huỳnh đioxit là chất oxi hóa:
SO2 + 2H2S → 3S + 2H2O
Lưu huỳnh đioxit là chất khử
7. Tính chất vật lí của SO2
Khí lưu huỳnh là chất khí không màu, nặng hơn không khí, mùi hắc, độc, tan nhiều trong nước. Có nhiệt độ nóng -72 độ C và nhiệt độ sôi -10 độ C. Ngoài ra, khí này có khả năng làm vẩn đục nước sôi, làm mất màu dung dịch brom và cánh hoa hồng.
8. Bài tập vận dụng liên quan
Câu 1. Khi điều chế Na, người ta điện phân nóng chảy NaCl với anot làm bằng:
A. thép
B. nhôm.
C. than chì.
D. magie.
Hướng dẫn giải
Đáp án C
Câu 2. Cho các phát biểu sau về ứng dụng của kim loại kiềm:
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
(4) Kim loai kiềm dùng để làm điện cực trong pin điện hóa
(5) Kim loại kiềm dùng để gia công các chi tiết chịu mài mòn trong máy bay, tên lửa, ô tô
Trong các phát biểu trên, số phát biểu đúng là:
A. 1.
B. 2.
C. 3.
D. 4
Hướng dẫn giải
Đáp án C
Ứng dụng của kim loại kiềm :
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
Câu 3. Đặt một mẩu nhỏ natri lên một tờ giấy thấm gấp thành dạng thuyền. Đặt chiếc thuyền giấy này lên một chậu nước có nhỏ sẵn vài giọt phenolphtalein.
Dự đoán hiện tượng có thể quan sát được ở thí nghiệm như sau:
(a) Chiếc thuyền chạy vòng quanh chậu nước.
(b) Thuyền bốc cháy.
(c) Nước chuyển màu hồng.
(d) Mẩu natri nóng chảy.
Trong các dự đoán trên, số dự đoán đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Hướng dẫn giải
Đáp án D
Câu 4: Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
C. Cả 2 muối đều bị thủy phân tạo mỗi trường kiềm yếu.
D. Cả 2 muối đều có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Hướng dẫn giải
Đáp án A
Phát biểu A sai vì Na2CO3 không bị nhiệt phân
Câu 5. Nhận xét nào sau đây không đúng về SO2?
A. Khí này làm mất màu dung dịch nước brom và dung dịch thuốc tím.
B. Phản ứng được với H2S tạo ra S.
C. Liên kết trong phân tử là liên kết cộng hóa trị có cực
D. Được tạo ra khi sục khí O2 vào dung dịch H2S.
Hướng dẫn giải
Đáp án D
D. Sai. Không thể tạo SO2 khi sục khí O2 vào dung dịch H2S.
Câu 6. Hãy chỉ ra câu trả lời sai về SO2
A. SO2 làm đỏ quỳ tím
B. SO2 làm mất màu dung dịch Br2
C. SO2 là chất khí, màu vàng
D. SO2 làm mất màu cánh hoa hồng
Hướng dẫn giải
Đáp án C
SO2 là khí không màu chứ không phải màu vàng
SO2 tác dụng với nước trong quỳ tím ẩm tạo H2SO3 làm quỳ tím đổi màu
SO2 có tính khử nên làm mất màu nước brom và cánh hoa hồng
Câu 7. Phát biểu nào sau đây sai?
A. Ở nhiệt độ thường, H2S là chất khí không màu, có mùi trứng thối, rất độc.
B. Ở nhiệt độ thường, SO2 là chất khí không màu, mùi hắc, tan nhiều trong nước.
C. Ở nhiệt độ thường, SO3 là chất khí không màu, tan vô hạn trong nước.
D. H2SO4 đặc có tính háo nước rất mạnh.
Hướng dẫn giải
Đáp án C
Câu 8. Cho các phát biểu sau:
(a) Sục khí SO2 vào dung dịch NaOH dư tạo ra muối trung hòa Na2SO3.
b) SO2 vừa có tính khử, vừa có tính oxi hóa.
(c) Khí SO2 là một trong những nguyên nhân chính gây ra mưa axit.
(d) Khí SO2 có màu vàng lục và rất độc.
Số phát biểu đúng là:
A. 3
B. 1
C. 4
D. 2
Hướng dẫn giải
Đáp án A
Phát biểu đúng là a, b, c
d sai vì SO2 không màu
Câu 9. Chỉ ra câu trả lời không đúng về khả năng phản ứng của S?
A. S vừa có tính oxi hoá vừa có tính khử.
B. Hg phản ứng với S ngay nhiệt độ thường.
C. Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá.
Hướng dẫn giải
Đáp án C
Vi dụ: S phản ứng với oxi thể hiện tính khử: S + O2 → SO2
Câu 10. Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thoát ra 1,792 lít H2. Thành phần phần trăm về khối lượng của A là
A. 18,75%.
B. 10,09%.
C. 13,13%.
D. 55,33%.
Hướng dẫn giải
Đáp án A
Gọi công thức chung của 2 kim loại kiềm là M
Phương trình phản ứng tổng quát là
M + H2O → MOH + 12H2
nM = 2 nH2 = 0,16 mol → M = 21
=> Li (7) < M = 21 < K (39)
Gọi số mol của K và Li lần lượt là x và y:
Ta có hệ phương trình phản ứng sau
39x + 7y = 3,36
x + y = 0,16
→ x = 0,07, y = 0,09
%mLi = 0,09.73,36.100%= 18,75%
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




