Phản ứng: BaCO3 + H2SO4 → H2O + CO2 ↑ + BaSO4 ↓
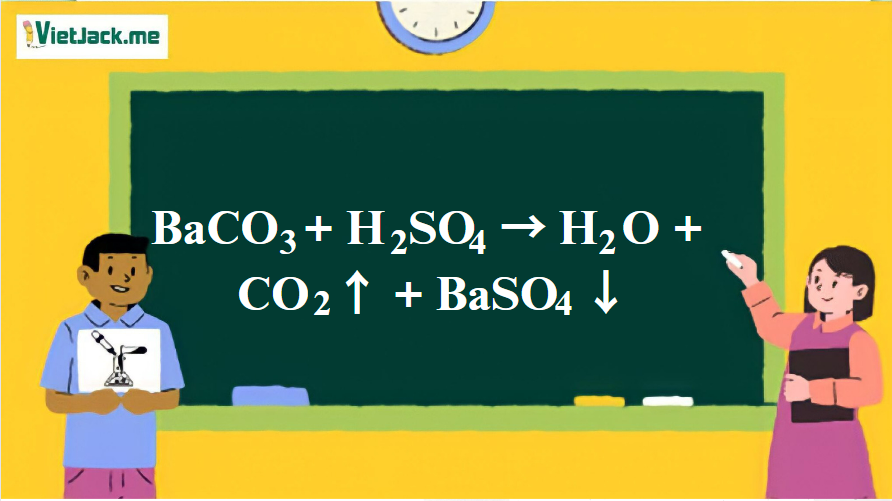
1. Phương trình phản ứng hóa học giữa BaCO3 và H2SO4
BaCO3 + H2SO4 → H2O + CO2 + BaSO4↓
2. Điều kiện phản ứng
– Không có
3. Cách thực hiện phản ứng
– Cho BaCO3 tác dụng với dung dịch H2SO4
4. Hiện tượng nhận biết phản ứng
– Xuất hiện kết tủa trắng bari cacbonat và có khí CO2 thoát ra
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của BaCO3
Bản chất của BaCO3 là một muối carbonat không tan trong nước tác dụng được với axit.
5.2 Bản chất của H2SO4
Bản chất của H2SO4 là một axit mạnh và có khả năng tạo liên kết ion.
6. Tính chất hóa học của BaCO3
– Mang tính chất hóa học của muối:
6.1 Tác dụng với axit mạnh:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
6.2 Kém bền với nhiệt:
BaCO3 –to→ BaO + CO2
7. Tính chất hóa học của H2SO4 loãng
7.1. Làm đổi màu quỳ tím thành đỏ
7.2. Axit sunfuric loãng tác dụng với kim loại
Axit sunfuric loãng có khả năng tác dụng với kim loại đứng trước hidro trong dãy hoạt động hóa học của kim loại
Tác dụng với kim loại (Al, Fe, Zn, Mg,…) → muối sunfat + khí hidro
Ví dụ:
Fe + H2SO4 (loãng) → FeSO4 + H2
Mg + H2SO4 → MgSO4 + H2
7.3. Axit sunfuric loãng tác dụng với bazơ
Tác dụng với bazơ → muối sunfat + nước
Thí dụ:
H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
7.4. Axit sunfuric loãng tác dụng với oxit bazơ
Tác dụng với oxit bazơ → muối sunfat + nước
Ví dụ:
BaO + H2SO4 → BaSO4 + H2O
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + CuO → CuSO4 + H2O
7.5. Axit sunfuric loãng tác dụng với muối
Tác dụng với muối → muối (mới) + axit(mới)
BaCl2 + H2SO4 → BaSO4 + HCl
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
8. Tính chất hóa học của H2SO4 đặc
Trong H2SO4 thì S có mức oxi hóa +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.
Có những tính chất hóa học riêng
8.1. Axit sunfuric đặc tác dụng với kim loại trừ (Au, Pt)
Axit sunfuric tác dụng với kim loại tạo muối và nhiều sản phẩm oxi hóa khác nhau như SO2, H2S, S.
Ví dụ:
Cu + H2SO4 → CuSO4 + SO2 + H2O
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc, nguội
8.2. Tính háo nước của axit sunfuric đặc
C12H22O11 11H2O + 12C
8.3. Axit sunfuric đặc tác dụng với phi kim
C + 2H2SO4 đặc nóng → CO2 + 2SO2 + 2H2O
S + 2H2SO4 đặc nóng → 3SO2 + 2H2O
8.4. Axit sunfuric đặc tác dụng với các chất khử khác
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O
9. Ứng dụng BaCO3
– Hóa chất BaCO3 dùng trong công nghiệp sản xuất thủy tinh, sản xuất kính và gốm sứ, gạch men…
– BaCO3 công nghiệp dùng trong các loại thuốc trừ các loài gậm nhấm, chất trợ dung trong gốm sứ, chất tinh quang học và các bóng đèn hình TV.
– Ngoài ra ngành sản xuất gạch, thuốc duyệt chuột có dùng Hóa chất BaCO3 (Barium Carbonate)
10. Bạn có biết
CaCO3 cũng có phản ứng tương tự
11. Ví dụ minh họa
Ví dụ 1: Bari có cấu trúc tinh thể theo kiểu nào?
A. Lập phương tâm khối
B. Lục phương
C. Lập phương tâm diện
D. Khác
Đáp án: A
Hướng dẫn giải
Bari có cấu trúc tinh thể dạng lập phương tâm khối
Ví dụ 2: Để bảo quản Bari người ta cất giữ ở đâu
A. trong không khí B. trong dầu
C. trong nước D. trong axit
Đáp án: B
Hướng dẫn giải
Vì bari nhạy cảm với không khí nên các mẫu bari thường được cất giữ trong dầu
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




