Phản ứng: Br2 + H2S ⟶ S + HBr
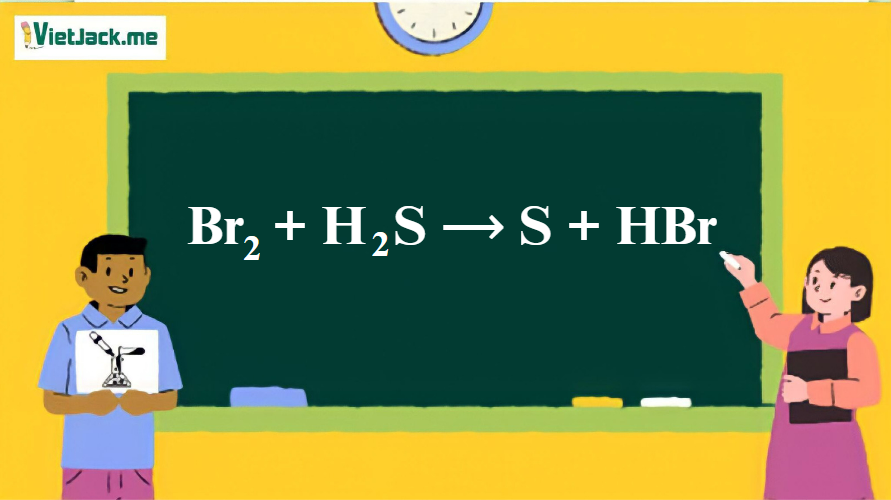
1. Phương trình phản ứng hóa học giữa Br2 và H2S
Br2 + H2S ⟶ 2S + 2HBr
2. Điều kiện xảy ra phản ứng
Không có
3. Cách thức thực hiện phản ứng
Dẫn nước Brom qua khí H2S
4. Hiện tượng nhận biết sau khi phản ứng xảy ra
Dung dịch Brom (Br2) bị mất màu da cam và xuất hiện kết tủa vàng Lưu hùynh (S).
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của Br2
5.2 Bản chất của H2S
6. Tính chất hóa học của Br2
6.1 Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
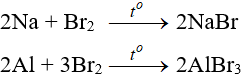
6.2 Tác dụng với hidro
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
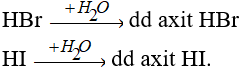
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
6.3 Tính khử của Br2, HBr
– Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
– Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
– Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
7. Tính chất hóa học của H2S
7.1 Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
7.2 Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,…mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
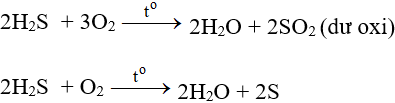
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
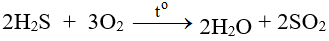
Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
8. Tính chất vật lí của H2S
– Hiđro sunfua (H2S) là chất khí rất độc, không màu, mùi trứng thối, nặng hơn không khí.
– Hóa lỏng ở -60oC, hóa rắn ở -86oC.
– Độ tan trong nước S = 0,38g/100g H2O (ở 20oC, 1atm).
9. Bài tập vận dụng liên quan
Câu 1. Nhận định nào sau đây không đúng:
A. Axit sunfuhiđric có tính axit mạnh hơn axit cacbonic.
B. Axit sunfuhiđric không làm phenolphtalein chuyển màu hồng.
C. Axit sunfuhiđric tác dụng với dung dịch kiềm có khả năng tạo 2 muối.
D. Cả dung dịch H2S và khí H2S đều có tính khử.
Đáp án A
A sai: Axit sunfuhiđric có tính axit mạnh hơn axit cacbonic.
Axit sunfuhiđric là axit rất yếu, yếu hơn axit cacbonic.
Câu 2. Cho sơ đồ của phản ứng: H2S + KMnO4 + H2SO4 → H2O + S + MnSO4 + K2SO4.Hệ số nguyên nhỏ nhất của các chất tham gia phản ứng là dãy số nào trong các dãy sau?
A. 3, 2, 5
B. 5, 2, 3
C. 2, 2, 5
D. 5, 2, 4
Đáp án B
5H2S + 2KMnO4+ 3H2SO4 → 8H2O + 5S + 2MnSO4 + K2SO4
Câu 3. Các đồ vật bằng bạc để lâu trong không khí thường bị xỉn màu đen. Nguyên nhân gây ra hiện tượng này là do:
A. Bạc tác dụng với O2 trong không khí.
B. Bạc tác dụng với hơi nước.
C. Bạc tác dụng đồng thời với khí O2 và H2S trong không khí.
D. Bạc tác dụng với khí CO2.
Đáp án C
Trong không khí có chứa các chất O2, H2S, hơi nước… Vì vậy Ag tác dụng đồng thời với O2 và H2S tạo muối Ag2S màu đen gây ra hiện tượng xỉn màu.
4Ag + O2 + 2H2S → 2Ag2S + 2H2O
Câu 4. Tính chất nào dưới đây là tính chất đặc trưng của khí hiđro sunfua ?
A. Là chất khí không màu.
B. Là chất khí độc.
C. Là chất khí có mùi trứng thối.
D. Cả 3 phương án trên đều đúng.
Đáp án D
Tính chất đặc trưng của khí hiđro sunfua là chất khí không màu, độc, có mùi trứng thối.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




