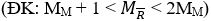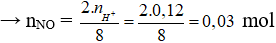Mời các bạn học sinh cùng tham khảo Bộ Đề kiểm tra Hóa học 12 Học kì 2 có đáp án năm 2024 do trang Giải Bài Tập tổng hợp. Hi vọng bộ đề thi này sẽ giúp bạn ôn luyện để đạt điểm cao trong bài thi Hóa học 12.
Mục lục
Thời gian làm bài: 15 phút
Đề 1
Cho nguyên tử khối của các nguyên tố: O = 16, H = 1, C = 12, Na = 23, Li = 7, K = 39, Rb = 85, Cs = 133.
Câu 1: Phương pháp nhiệt luyện thường dùng để điều chế các kim loại
A. hoạt động trung bình như Fe, Zn…
B. hoạt động mạnh như Ca, Na…
C. mọi kim loại như Cu, Na, Fe, Al…
D. kém hoạt động như Ag, Au…
Câu 2: Trong các kim loại sau, kim loại có nhiệt độ nóng chảy thấp nhất là
A. Cs.
B. Li.
C. Ba.
D. Be.
Câu 3: Thạch cao sống là chất nào sau đây?
A. CuSO4.5H2O.
B. CaSO4.
C. CaSO4. 2H2O.
D. CaCO3.
Câu 4: Phát biểu nào sau đây là sai?
A. Nước chứa nhiều ion: Ca2+, Mg2+ được gọi là nước cứng.
B. Nấu ăn bằng nước cứng làm tăng mùi vị của món ăn.
C. Nước mềm là nước có chứa ít hoặc không chứa các ion: Ca2+, Mg2+.
D. Khi cho xà phòng vào nước cứng sẽ có kết tủa.
Câu 5: Hãy cho biết phản ứng nào sau đây không xảy ra ở điều kiện thường?
A. CaO + H2O → Ca(OH)2.
B. 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2.
C. Be + 2H2O → Be(OH)2 + H2.
D. Ba + 2H2O → Ba(OH)2 + H2.
Câu 6: Hấp thụ hết 5,6 lít CO2 (ở đktc) vào dung dịch chỉ chứa 29,925 gam Ba(OH)2 thu được a gam kết tủa Y. Giá trị của a là
A. 15 gam.
B. 14,8 gam.
C. 19,7 gam.
D. 34,5 gam.
Câu 7: Cho 3,8 gam hỗn hợp muối M2CO3 và MHCO3 (M là kim loại kiềm) vào dung dịch H2SO4 2M (dư), sinh ra 0,496 lít khí (đktc). M là
A. K.
B. Li.
C. Rb.
D. Na.
Câu 8: Cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 sẽ
A. có kết tủa trắng.
B. có bọt khí.
C. có kết tủa trắng và bọt khí.
D. không có hiện tượng gì.
Câu 9: Cho 8,52 gam hỗn hợp X gồm: Ca, MgO, Na2O tác dụng hết với 360 ml dung dịch HCl 1M (vừa đủ) thu được dung dịch Y. Khối lượng (gam) NaCl có trong Y là
A. 2,34.
B. 8,75.
C. 5,21.
D. 7,02.
Câu 10: Trong các phát biểu sau:
(1) Li có cấu trúc mạng tinh thể lập phương tâm khối, được ứng dụng chế tạo hợp kim siêu nhẹ.
(2) NaOH được sử dụng để nấu xà phòng, sản xuất tơ nhân tạo.
(3) CaCO3 là chất rắn, màu trắng, tan tốt trong nước.
(4) Nguyên tắc làm mềm nước cứng là làm giảm nồng độ các ion Ca2+, Mg2+ có trong nước cứng.
(5) KNO3 được ứng dụng để làm thuốc chữa bệnh đau dạ dày do thừa axit.
Phát biều không đúng là
A. (1), (2).
B. (3), (4).
C. (2), (4).
D. (3), (5).
Đáp án đề số 1
Biểu điểm 1 điểm / 1 câu :
Câu 1: A
Những kim loại có độ hoạt động trung bình như Zn, Fe, Sn, Pb … thường được điều chế bằng phương pháp nhiệt luyện, nghĩa là khử ion kim loại trong hợp chất ở nhiệt độ cao bằng các chất khử như C, CO, H2 hoặc các kim loại hoạt động.
Câu 2: A
Kim loại có nhiệt độ nóng chảy thấp nhất trong dãy là Cs (nóng chảy ở 29°C).
Câu 3: C
Thạch cao sống: CaSO4. 2H2O.
Câu 4: B
B sai vì nấu ăn bằng nước cứng sẽ làm thực phẩm lâu chín và giảm mùi vị.
Câu 5: C
Be không tác dụng với H2O ở điều kiện thường.
Câu 6: C
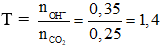
Bảo toàn C: x + 2y = 0,25 (1)
Bảo toàn Ba: x + y = 0,175 (2)
Từ (1) và (2) có x = 0,1 và y = 0,075
Kết tủa là BaCO3 → a = 0,1.197 = 19,7 gam.
Câu 7: C
Đặt 2 muối tương đương với một muối là 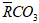
Bảo toàn C có:
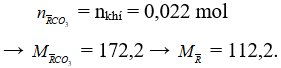
Có MM + 1 < 112,2 < 2MM → 56,1 < MM < 111,2 → M là Rb.
Câu 8: A
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 (↓ trắng) + 2H2O.
Câu 9: D
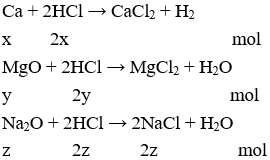
Có mx = 8,52 → 40x + 40y + 62z = 8,52 (1)
naxit = 0,72 → 2x + 2y + 2z = 0,36 (2)
Từ (1) và (2) giải hệ được x + y = 0,12; z = 0,06
→ mNaCl = 2z.58,5 = 2. 0,06.58,5 = 7,02 gam.
Câu 10: D
(3) sai vì CaCO3 không tan trong nước.
(5) sai vì NaHCO3 được dùng làm thuốc chữa bệnh đau dạ dày do thừa axit.
Đề số 2
Cho nguyên tử khối của các nguyên tố: O = 16, H = 1, C = 12, Ca = 40, Mg = 24, Ba = 137, Cu = 64.
I. Phần trắc nghiệm (3 điểm)
Câu 1: Kim loại nào sau đây được điều chế bằng phương pháp điện phân hợp chất nóng chảy?
A. Zn.
B. Fe.
C. K.
D. Cu.
Câu 2: Nguyên tử của kim loại kiềm có n lớp electron. Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là
A. ns2.
B. (n -1)dxnsy.
C. ns1.
D. ns2np1.
Câu 3: Một loại nước cứng khi đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những hợp chất nào sau đây?
A. Ca(HCO3)2, Mg(HCO3)2.
B. Mg(HCO3)2, CaCl2.
C. CaSO4, MgCl2.
D. Ca(HCO3)2, MgCl2.
Câu 4: Dung dịch nào dưới đây khi phản ứng hoàn toàn với dung dịch NaOH dư, thu được kết tủa trắng?
A. Ca(HCO3)2.
B. H2SO4.
C. FeCl3.
D. AlCl3.
Câu 5: Một mẫu khí thải có chứa CO2, NO2, N2 và SO2 được sục vào dung dịch Ca(OH)2 dư. Trong bốn khí đó, số khí bị hấp thụ là
A. 4.
B. 1.
C. 2.
D. 3.
Câu 6: Xếp các kim loại kiềm thổ theo chiều tăng của điện tích hạt nhân thì
A. khả năng tác dụng với nước giảm dần.
B. tính khử giảm dần.
C. năng lượng ion hóa giảm dần.
D. bán kính nguyên tử giảm dần.
II. Phần tự luận (7 điểm)
Câu 1 (2 điểm): Viết các PTHH xảy ra trong các trường hợp sau:
a/ Điện phân nóng chảy NaCl.
b/ NaHCO3 tác dụng với HCl.
c/ K tác dụng với H2O.
d/ CO2 tác dụng với Ca(OH)2 dư.
Câu 2 (3 điểm): Cho 1,37 gam Ba vào 1 lít dung dịch CuSO4 0,01 M. Sau khi các phản ứng xảy ra hoàn toàn, tính khối lượng kết tủa thu được.
Câu 3 (2 điểm): Nhiệt phân hoàn toàn 40 gam một loại quặng đôlômit có lẫn tạp chất trơ sinh ra 8,96 lít khí CO2 (ở đktc). Tính thành phần phần trăm về khối lượng của CaCO3.MgCO3 trong loại quặng nêu trên.
Đáp án đề số 2
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 |
| Đ/a | C | C | A | A | D | C |
Câu 1: Những kim loại hoạt động mạnh như K, Na, Ca, Mg, Al được điều chế bằng phương pháp điện phân nóng chảy các hợp chất của kim loại. Chọn đáp án C.
Câu 2: Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là ns1. Chọn đáp án C.
Câu 3:
Ca(HCO3)2 CaCO3 (↓) + CO2 + H2O
Mg(HCO3)2 MgCO3 (↓) + CO2 + H2O
Chọn đáp án A.
Câu 4:
OH– + HCO3– → CO32- + H2O
Ca2+ + CO32- → CaCO3 (↓ trắng)
Chọn đáp án A.
Câu 5: Có 3 khí trong dãy bị hấp thụ là CO2, SO2 và NO2. Chọn đáp án D.
Câu 6: Xếp các kim loại kiềm thổ theo chiều tăng của điện tích hạt nhân thì năng lượng ion hóa giảm dần. Chọn đáp án C.
2. Phần tự luận
Câu 1: (2 điểm) HS viết đúng mỗi PTHH 0,5 điểm, không cân bằng trừ ½ số điểm mỗi PTHH.
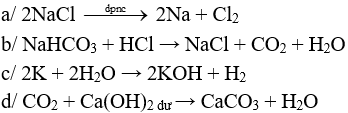
Câu 2: (3 điểm) Tính được: nBa = 0,01 mol, nCuSO4 = 0,01 mol.
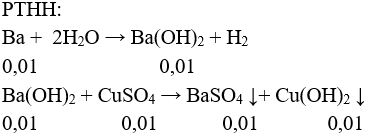
m↓ = mBaSO4 + mCu(OH)2 = 0,01.233 + 0,01.98 = 3,31 gam.
Câu 3: (3 điểm) Tính được số mol CO2 = 0,4 mol
Bảo toàn C có: nMgCO3.CaCO3 = 0,2 mol.
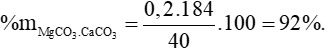
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Đề số 3
Cho nguyên tử khối của các nguyên tố: O = 16, H = 1, C = 12, Zn = 65, Al = 27, Fe = 56.
Câu 1: Vị trí của Crom (z = 24) trong bảng tuần hoàn là
A. ô 24, chu kỳ 4, nhóm VIA.
B. ô 24, chu kỳ 4, nhóm VIB.
C. ô 24, chu kỳ 4, nhóm IB.
D. ô 24, chu kỳ 4, nhóm IIB.
Câu 2: Cho 3,2 gam Cu tác dụng với 100ml dung dịch hỗn hợp (HNO3 0,8M + H2SO4 0,2M), sản phẩm khử duy nhất của HNO3 là NO. Thể tích khí NO (đktc) là
A. 0,672 lít.
B. 0,336 lít.
C. 0,747 lít.
D. 1,792 lít.
Câu 3: Trong các loại quặng sắt sau, quặng có hàm lượng sắt cao nhất là
A. hematit đỏ.
B. xiđerit.
C. hematit nâu.
D. manhetit.
Câu 4: Chia bột kim loại X thành 2 phần. Phần một cho tác dụng với Cl2 tạo ra muối Y. Phần 2 cho tác dụng với dd HCl tạo ra muối Z. Cho kim loại X tác dụng với muối Y lại thu được muối Z. Vậy X là kim loại nào sau đây?
A. Mg.
B. Al.
C. Zn.
D. Fe.
Câu 5: Thí nghiệm nào sau đây tạo ra muối sắt (II)?
A. Đun nóng hỗn hợp Fe và S.
B. Đốt dây sắt trong bình khí clo.
C. Cho sắt vào dung dịch HNO3 loãng, dư.
D. Cho FeO tác dụng với dung dịch HNO3, đặc nóng.
Câu 6: Khi nung hỗn hợp các chất Fe(NO3)2, Fe(OH)2 và FeCO3 trong không khí đến khối lượng không đổi, thu được một chất rắn là
A. Fe3O4.
B. FeO.
C. Fe.
D. Fe2O3.
Câu 7: Hoà tan hỗn hợp gồm: Na2O, BaO, Al2O3, FeO vào nước (dư), thu được dung dịch X và một chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là
A. Fe(OH)3.
B. K2CO3.
C. Al(OH)3.
D. BaCO3.
Câu 8: Dãy kim loại bị thụ động trong axit HNO3 đặc, nguội là
A. Fe, Al, Cr.
B. Fe, Al, Ag.
C. Fe, Al, Cu.
D. Fe, Zn, Cr
Câu 9: Cho 4,9 gam hỗn hợp Fe và Cu (trong đó Cu chiếm 60% khối lượng) vào một lượng dung dịch HNO3 khuấy đều đến phản ứng hoàn toàn thấy còn lại 2,3 gam chất rắn không tan. Khối lượng muối tạo thành là
A. 8,18 g.
B. 6,5 g.
C. 10,07 g.
D. 8,35 g.
Câu 10: Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch H2SO4 10%, thu được 2,24 lít khí H2 (ở đktc). Khối lượng dung dịch thu được sau phản ứng là
A. 101,68 gam.
B. 88,20 gam.
C. 101,48 gam.
D. 97,80 gam.
Đáp án đề số 3
Biểu điểm 1 điểm / 1 câu :
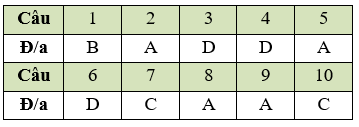
Câu 1: B
Ta có cấu hình electron của Cr: [Ar] 3d54s1
→ Crom ở ô thứ 24 do z = 24, chu kỳ 4 do có 4 lớp electron, nhóm VIB do có 6 electron hóa trị, nguyên tố d.
Câu 2: A
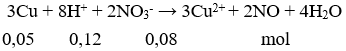
Sau phản ứng H+ hết đầu tiên
→ VNO = 0,03.22,4 = 0,672 lít.
Câu 3: D
Quặng hematit đỏ: Fe2O3
Quặng xiđerit: FeCO3
Quặng hematit nâu: Fe2O3.nH2O.
Quặng manhetit: Fe3O4.
→ Trong các loại quặng sắt, quặng có hàm lượng sắt cao nhất là manhetit.
Câu 4: D
2Fe + 3Cl2 → 2FeCl3
Fe + 2HCl → FeCl2 + H2
Fe + 2FeCl3 → 3FeCl2.
Câu 5. A
Fe + S → FeS
Câu 6: D
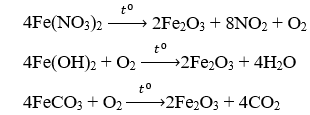
Câu 7: C
Dung dịch X chứa: Na+, Ba2+, AlO2–, có thể có OH–, chất rắn Y là FeO.
Sục CO2 dư vào X thu được kết tủa là Al(OH)3.
CO2 + 2H2O + AlO2– → Al(OH)3↓ + HCO3–
Câu 8: A
Dãy kim loại bị thụ động trong axit HNO3 đặc, nguội là Fe, Al, Cr.
Câu 9: A
Ta có mCu = 2,94 gam , mFe = 1,96 gam, nFe = 0,035 mol; nCu = 0,046 mol.
→ Sau phản ứng còn 2,3 gam < 2,94 gam → chất rắn không tan là Cu,dung dịch sau phản ứng chứa Cu(NO3)2 và Fe(NO3)2.
Có:
nFe(NO3)2 = nFe = 0,035 mol;
nCu(NO3)2 = nCu pư = 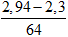
→ mmuối = mFe(NO3)2 + mCu(NO3)2 = 0,035.180 + 0,01. 188= 8,18 gam.
Câu 10: C
naxit = nkhí = 0,1 mol → mdd axit = 98 gam.
Bảo toàn khối lượng: mdd sau = mKL + mdd axit – mkhí = 3,68 + 98 – 0,1.2 = 101,48 gam.
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung học tập, giải trí và các kiến thức thú vị khác tại đây.