Phản ứng: CuSO4 + Na2S → CuS + Na2SO4
1. Phương trình hoá học của phản ứng CuSO4 tác dụng với Na2S
CuSO4 + Na2S → CuS↓ + Na2SO4
2. Điều kiện của phản ứng CuSO4 tác dụng với Na2S
– Phản ứng diễn ra ở ngay điều kiện thường.
3. Hiện tượng của phản ứng CuSO4 tác dụng với Na2S
– Xuất hiện kết tủa đen, dung dịch nhạt màu dần.
4. Phương trình ion thu gọn của phản ứng CuSO4 tác dụng với Na2S
Bước 1: Viết phương trình phân tử:
CuSO4 + Na2S → CuS↓ + Na2SO4
Bước 2: Chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất kết tủa, chất khí, chất điện li yếu để nguyên dưới dạng phân tử ta được phương trình ion đầy đủ:
Cu2+ + SO42- + 2Na+ + S2- → CuS↓+ SO42- + 2Na+
Bước 3: Lược bỏ đi các ion giống nhau ở hai vế ta được phương trình ion rút gọn:
Cu2+ + S2- → CuS↓
5. Tính chất hóa học của Na2S
5.1 Phản ứng với thuốc thử vô cơ
S2- + H2O → HS- + OH-
5.2 Phản ứng oxy hóa khi tiến hành đun nóng Na2S với natri cacbonat với lưu huỳnh dioxit
2Na2S + 3O2 + 2CO2 → 2NA2CO3 + 2SO2
5.3 Phản ứng oxy hóa cùng với hidro peroxit
Na2S + 4H2O2 → 4H2O + Na2SO4
5.4 Cho lưu huỳnh phản ứng với natri sunfua tạo thành polysulfides
2Na2S + S8 → 2Na2S5
5.5 Natri sunfua + HCl sinh ra H2S – một loại khí độc với mùi hôi thối
Na2S + 2HCl → 2NaCl + H2S
6. Tính chất hóa học của CuSO4
– Có tính chất hóa học của muối.
6.1 Tác dụng với dung dịch bazo:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4
6.2 Tác dụng với muối:
BaCl2 + CuSO4 → CuCl2 + BaSO4
7. Tính chất vật lí của CuSO4
CuSO4 là hợp chất muối màu xanh lam, dạng tinh thể rắn hoặc bột. Hòa tan được trong nước, methanol nhưng không tan được trong ethanol. Khối lượng mol của CuSO4 là 159.62 g/mol (khan) và 249.70 g/mol (ngậm 5 nước). Khối lượng riêng của CuSO4 là 3.603 g/cm3 (khan) và 2.284 g/cm3 (ngậm 5 nước).
8. Mở rộng về phản ứng trao đổi trong dung dịch chất điện li
Xét phản ứng:
Dung dịch A + dung dịch B → Sản phẩm.
– Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
– Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất 1 trong số các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
Thí dụ:
+ Phản ứng tạo thành chất kết tủa:
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
+ Phản ứng tạo thành chất điện li yếu:
HCl + NaOH → NaCl + H2O
+ Phản ứng tạo thành chất khí:
Fe + H2SO4 loãng → FeSO4 + H2↑
9. Bài tập vận dụng liên quan
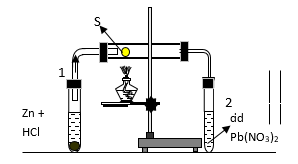
Câu 1: Cho thí nghiệm được lắp như như hình vẽ sau:
Ống nghiệm 1 đựng HCl và Zn, ống nghiệm nằm ngang chứa bột S, ống nghiệm 2 chứa dung dịch Pb(NO3)2 . Phản ứng xảy ra trong ống nghiệm nằm ngang là:
A. Zn + 2HCl → ZnCl2 + H2
B. H2 + S →to H2S
C. H2S + Pb(NO3)2 → PbS↓ + 2HNO3
D. 2HCl + Pb(NO3)2 → PbCl2↓ + 2HNO3
Hướng dẫn giải:
Đáp án B
– Ống nghiệm (1): Zn phản ứng với HCl sinh ra khí H2
Zn + 2HCl → ZnCl2 + H2
– Ống nghiệm nằm ngang: H2 bay ra gặp S (đun nóng) thì có phản ứng:
H2 + S →toH2S
– Ống nghiệm (2): Khí H2S bay ra khỏi ống nghiệm nằm ngang phản ứng với dung dịch Pb(NO3)2 tạo kết tủa màu đen
H2S + Pb(NO3)2 → PbS ↓ + 2HNO3
Câu 2:Cho m gam hỗn hợp bột Fe và S với tỉ lệ số mol sắt bằng 2 lần số mol lưu huỳnh, rồi đem nung (không có oxi), thu được hỗn hợp A. Hòa tan A bằng dung dịch HCl dư thu được 0,4 gam chất rắn B, dung dịch C và khí D. Sục khí D từ từ qua dung dịch CuCl2 dư thấy tạo ra 4,8 gam kết tủa đen. Tính hiệu suất phản ứng tạo thành hỗn hợp A?
A. 90%
B. 85%
C. 80%
D. 70%
Hướng dẫn giải:
Đáp án C
Sơ đồ bài toán:
Fe:2xS:x→toFeS:yFedu:2x−ySdu:x−y→+HClKhiH2H2S:y→+CuCl2CuS:yChatranSdu:x−y
nCuS = y= 0,05 mol
Chất rắn B là lưu huỳnh: nS = x – y = 0,0125 mol
→ x = 0,0625 mol
Hiệu suất của phản ứng: H = 80%
Câu 3: Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
A. Có phản ứng oxi hóa – khử xảy ra
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh
C. Axit sunfuhiđric mạnh hơn axit sunfuric
D. axit sunfuric mạnh hơn axit sunfuhiđric
Hướng dẫn giải:
Đáp án B
H2S + CuSO4 → CuS↓ + H2SO4
Câu 4:Phương trình phản ứng: Ba(OH)2 + 2HCl → BaCl2 + 2H2O có phương trình ion rút gọn là:
A.H+ + OH– → H2O
B. Ba2+ + 2OH– + 2H+ + 2Cl– → BaCl2 + 2H2O
C. Ba2+ + 2Cl– → BaCl2
D. Cl– + H+ → HCl
Hướng dẫn giải:
Đáp án A
Phương trình phân tử:
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Phương trình ion đầy đủ:
Ba2+ + 2OH– + 2H+ + 2Cl–→ Ba2+ + 2Cl– + 2H2O
Phương trình ion rút gọn:
H+ + OH– → H2O
Câu 5:Cho phản ứng: Mg(OH)2 + 2HCl → MgCl2 + H2O.
Phương trình ion thu gọn của phản ứng trên là
A. HCl + OH – → H2O + Cl–.
B. 2H+ + Mg(OH)2 → Mg2+ + 2H2O.
C. H+ + OH – → H2O.
D. 2HCl + Mg(OH)2 → Mg2+ + 2Cl– + 2H2O.
Hướng dẫn giải:
Đáp án B
Ta có phản ứng: Mg(OH)2 + 2HCl → MgCl2 + 2H2O.
Phương trình ion đầy đủ là: Mg(OH)2 + 2H+ + 2Cl– → Mg2+ + 2Cl–+ 2H2O.
→ Phương trình ion thu gọn là: Mg(OH)2 + 2H+ → Mg2+ + 2H2O.
Câu 6:Phương trình ion rút gọn Ba2+ + SO42− → BaSO4 tương ứng với phương trình phân tử nào sau đây?
A. Ba(OH)2 + CuSO4 → BaSO4 + Cu(OH)2.
B. H2SO4 + BaCO3 → BaSO4 + CO2 + H2O.
C. Na2SO4 + Ba(NO3)2 → BaSO4 + 2NaNO3.
D. H2SO4 + Ba(OH)2 → BaSO4 + 2H2O.
Hướng dẫn giải:
Đáp án C
A. Ba2++2OH−+Cu2++SO42−→BaSO4↓+Cu(OH)2↓
B. 2H++SO42−+BaCO3→BaSO4+CO2+H2O
C. Ba2++SO42−→BaSO4↓
D. H++SO42−+Ba2++OH−→BaSO4↓+H2O
Câu 7: Để loại CuSO4 lẫn trong dung dịch FeSO4, cần dùng thêm lượng dư chất nào sau đây?
A. Al. B. Fe. C. Zn. D. Ni.
Hướng dẫn giải
Đáp án B
Thêm lượng dư Fe.
Phương trình phản ứng:
Fe + CuSO4 → FeSO4 + Cu
Kết thúc phản ứng, lọc bỏ kim loại thu được dung dịch FeSO4 tinh khiết.
Câu 8: Chất lỏng Boocđo là hỗn hợp CuSO4 và vôi tôi trong nước theo một tỉ lệ nhất định, chất lỏng này phải hơi có tính kiềm (vì nếu CuSO4 dư sẽ thấm vào mô thực vật gây hại lớn cho cây). Boocđo là một chất diệt nấm cho cây rất hiệu quả nên được các nhà làm vườn ưa dùng, hơn nữa việc pha chế nó cũng rất đơn giản. Để phát hiện CuSO4 dư nhanh, có thể dùng phản ứng hóa học nào sau đây?
A. Glixerol tác dụng với CuSO4 trong môi trường kiềm.
B. Sắt tác dụng với CuSO4.
C. Amoniac tác dụng với CuSO4.
D. Bạc tác dụng với CuSO4.
Hướng dẫn giải
Đáp án B
Chất lỏng Boocđo gồm những hạt rất nhỏ muối đồng(II) sunfat, bazơ không tan và canxi sunfat.
4CuSO4 + 3Ca(OH)2 → CuSO4.3Cu(OH)2 + 3CaSO4
Để thử nhanh thuốc diệt nấm này tức là phát hiện đồng(II) sunfat dư, người ta dùng đinh sắt: sắt tan ra, có kim loại Cu đỏ xuất hiện.
Fe + CuSO4 → FeSO4 + Cu↓
Câu 9: Khối lượng tinh thể đồng (II) sunfat ngậm nước (CuSO4.5H2O) cần lấy để pha được 250 ml dung dịch CuSO4 0,15M là
A. 6,000 g. B. 9,375 g. C. 9,755 g. D. 8,775 g.
Hướng dẫn giải
Đáp án B
nCuSO4=0,25.0,15 = 0,0375 mol
→nCuSO4.5H2O = nCuSO4=0,0375 mol
→mCuSO4.5H2O = 0,0375.250 = 9,375 gam
Câu 10: Cho dung dịch CuSO4 tác dụng vừa đủ với dung dịch Ba(OH)2 dư thu được 33,1 g kết tủa. Số mol CuSO4 và khối lượng chất rắn thu được sau khi nung kết tủa trên đến khối lượng không đổi là:
A. 0,1 mol; 33,1 g. B. 0,1 mol; 31,3 g.
C. 0,12 mol; 23,3 g. D. 0,08 mol; 28,2 g.
Hướng dẫn giải
Đáp án B
CuSO4+BaOH2→CuOH2+BaSO4xxxxmol
→ m↓=mCu(OH)2+mBaSO4
→ 33,1 = 98x + 233x → x = 0,1 mol
Cu→t°CuO+H2O0,1→0,1mol
m rắn = mCuO + mBaSO4= 0,1.80 + 233.0,1 = 31,3 gam
Câu 11:Điện phân (với điện cực trơ) 200 ml dung dịch CuSO4 nồng độ x mol/l, sau một thời gian thu được dung dịch Y vẫn còn màu xanh, có khối lượng giảm 8 gam so với khối lượng ban đầu. Cho 16,8 gam bột sắt vào Y, sau khi các phản ứng xảy ra hoàn toàn, thu được 12,4 gam kim loại. Giá trị của x là:
A. 1,25 B. 2,25 C. 1,50 D. 3,25
Hướng dẫn giải
Đáp án A
2CuSO4+2H2O→dp2Cu+2H2SO4+O2xx0,5x(mol)
Gọi số mol Cu sinh ra là x mol → số mol O2 là 0,5x mol
→ mgiảm = mCu + mO2
→ 8 = 64x + 32.0,5x → x = 0,1 mol
→ Dung dịch Y chứa H2SO4: 0,1 mol và CuSO4 dư y mol
Khi cho 0,3 mol Fe vào dung dịch Y thu được dung dịch chứa FeSO4: 0,1 + y (mol)
→ Hỗn hợp kim loại gồm Fe dư: 0,3 – (0,1 + y) mol và Cu: y mol
→ 56 [0,3 – (0,1 + y)] + 64y = 12,4 → y = 0,15 mol
→ Tổng số mol CuSO4 = x + y = 0,25 mol
→ x = 1,25.
Câu 12: Cho các phản ứng hóa học sau:
(1) NaHS + NaOH →
(2) Ba(HS)2 + KOH →
(3) Na2S + HCl →
(4) CuSO4 + Na2S →
(5) FeS + HCl →
(6) NH4HS + NaOH →
Các phản ứng đều có cùng một phương trình ion rút gọn là:
A. (3), (4), (5).
B. (1), (2).
C. (1), (2), (6).
D. (1), (6).
Hướng dẫn giải:
Đáp án B
(1) HS−+OH−→S2−+H2O
(2) HS−+OH−→S2−+H2O
(3) S2−+2H+→H2S
(4) S2−+Cu2+→CuS↓
(5) FeS+2H+→Fe2++H2S↑
(6) NH4++HS−+2OH−→NH3+H2O+S2−
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




