Phản ứng (NH4)2SO4 + NaOH → Na2SO4 + NH3↑ + H2O
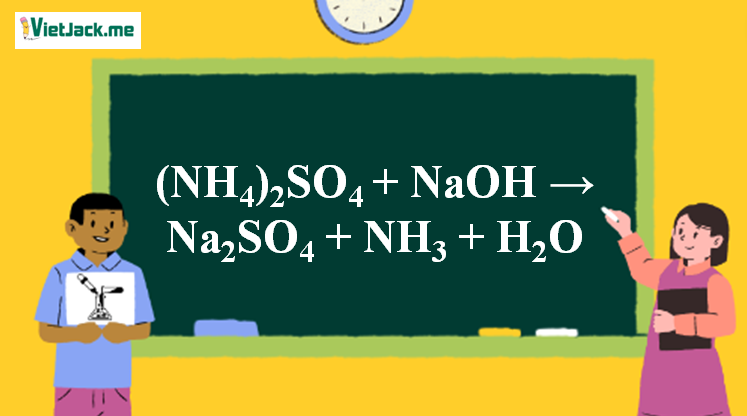
1. Phương trình phân tử phản ứng (NH4)2SO4 + NaOH
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3↑ + 2H2O
2. Phương trình ion rút gọn (NH4)2SO4 + NaOH
NH4+ + OH– → NH3↑ + H2O
3. Điều kiện phản ứng (NH4)2SO4 ra NH3
Nhiệt độ thường
4. Hiện tượng phản ứng (NH4)2SO4 tác dụng với NaOH
Cho (NH4)2SO4 tác dụng với dung dịch NaOH, phản ứng sinh ra khí amoniac.
5. Tính chất hoá học của muối amoni
5.1.Phản ứng thuỷ phân
Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
5.2. Tác dụng với dung dịch kiềm
(nhận biết ion amoni, điều chế amoniac trong phòng thí nghiệm)
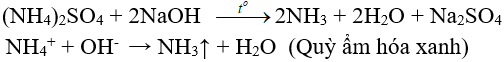
5.3. Phản ứng nhiệt phân
– Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
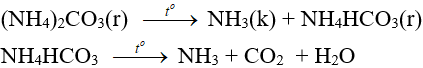
NH4HCO3 (bột nở) được dùng làm xốp bánh.
– Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
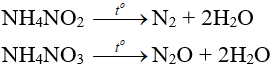
– Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
6. Tính chất hoá học của NaOH
NaOH là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với axit hữu cơ tạo thành muối và thủy phân este, peptit:
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
7. Câu hỏi vận dụng liên quan
Câu 1. Dung dịch nào sau đây không làm đổi màu quì tím ?
A. NaOH
B. HCl
C. KCl
D. NH3
Lời giải:
Câu 2. Dãy các muối nào sau đây nhiệt phân đều cho sản phẩm là khí NH3?
A. NH4HCO3, NH4Cl, (NH4)2CO3
B. NH4NO3, (NH4)2SO4, (NH4)2CO3
C. NH4NO2, NH4Cl, (NH4)2CO3
D. NH4NO3, NH4Cl, (NH4)2SO4
Lời giải:
Câu 3. Cho từ từ dung dịch (NH4)2SO4 vào dung dịch NaOH. Hiện tượng xảy ra là
A. Có kết tủa trắng
B. Không có hiện tượng
C. có khí mùi khai bay lên và có kết tủa trắng
D. có khí mùi khai bay lên
Lời giải:
Câu 4. Cho dung dịch NH3 đến dư vào 200 ml dung dịch Al2(SO4)3. Lọc lấy chất kết tủa và cho vào 100 ml dung dịch KOH 2M thì kết tủa vừa tan hết. Nồng độ mol của dung dịch Al2(SO4)3 đã dùng là
A. 1M
B. 0,25M
C. 0,5M
D. 0,75M
Lời giải:
Phương trình phản ứng hóa học xảy ra:
6NH3 + Al2(SO4)3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4 (1)
NaOH + Al(OH)3 → NaAlO2 + H2O (2)
Theo phương trình ta có:
nAl(OH)3 = nNaOH = 0,02.2 = 0,04 mol
→ nAl2(SO4)3 = 12. nAl(OH)3 = 0,02 mol
→ CM Al2(SO4)3= 0,020,04 = 0,5 M
Câu 5. Cho các dung dịch sau: NH4Cl, Na2SO4, Ba(HCO3)2. Hóa chất nào sau đây có thể sử dụng để phân biệt các dung dịch đó?
A. Dung dịch KCl.
B. Dung dịch NaOH.
C. Dung dịch C2H5OH
D. Dung dịch Ca(OH)2.
Lời giải
Đáp án: B
Dùng NaOH để nhận biết hỗn hợp dung dịch trên
Trích mẫu thử và đánh số thứ tự ta có
Xuất hiện mùi khai thì ống nghiệm đó chất ban đầu chứa NH4Cl
NH4Cl + NaOH → NH3 + H2O + NaCl
Xuất hiện kết tủa trắng thì chất ban đầu là Ba(HCO3)2
Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
Không có hiện tượng gì là Na2SO4
Xem thêm các phương trình hóa học khác:
(NH4)2SO4 + BaCl2 → NH4Cl + BaSO4
Pb(OH)2 + NaOH → Na2PbO2 + H2O
KClO3 + C → KCl + CO2
HClO + KOH → KClO + H2O
Hoàn thành sơ đồ sau: S → SO2 → SO3 → H2SO4
Cảm ơn bạn đã theo dõi bài viết tại Giải Bài Tập. Mời các bạn cùng xem các nội dung giải trí học tập và các kiến thức thú vị khác tại đây.




